ADAM9:超越蛋白水解的多功能調(diào)控因子
日期:2025-12-08 08:39:40
1. ADAM9結(jié)構(gòu)與生物學功能概覽
ADAM9是一種跨膜多結(jié)構(gòu)域蛋白,具有解整合素與金屬蛋白酶雙重功能,通過介導細胞黏附以及對底物蛋白進行胞外域剪切來調(diào)控多種細胞表面蛋白的功能。ADAM9蛋白結(jié)構(gòu)由信號肽、前域、金屬蛋白酶域、整合素結(jié)合相關的解整合素域、富含半胱氨酸的結(jié)構(gòu)域、EGF樣結(jié)構(gòu)域、跨膜區(qū)及胞內(nèi)短尾部構(gòu)成。其中,前域負責維持酶的失活狀態(tài),通過去除前肽實現(xiàn)成熟酶的激活;金屬蛋白酶域則具備典型的催化活性,可剪切多種細胞膜蛋白;解整合素域參與介導細胞黏附;而胞內(nèi)區(qū)含信號轉(zhuǎn)導相關基序,使ADAM9 能整合外部刺激與胞內(nèi)反應。ADAM9存在膜結(jié)合型與分泌型兩種主要同源異構(gòu)體,使其功能更加多樣化 [1]。
在生理過程中,ADAM9參與細胞黏附、遷移、蛋白質(zhì)剪切及組織重塑等關鍵事件,并在炎癥反應、神經(jīng)系統(tǒng)發(fā)育及視網(wǎng)膜結(jié)構(gòu)維持中發(fā)揮作用。其金屬蛋白酶介導的外切作用可調(diào)控多種受體與黏附分子的剪切,包括 Tie-2、VEGFR2、VCAM-1等,從而影響血管生成、免疫細胞遷移與細胞間通訊。另一方面,ADAM9的表達變化與多種病理狀態(tài)密切相關,如退行性疾病、組織損傷以及多種腫瘤。在癌癥中,ADAM9通過蛋白酶依賴與非依賴機制促進腫瘤進展、耐藥性及轉(zhuǎn)移,其高表達往往對應更具侵襲性的臨床表現(xiàn)。總體而言,ADAM9兼具結(jié)構(gòu)多樣性與功能復雜性,是維持組織穩(wěn)態(tài)與驅(qū)動疾病發(fā)生的重要分子,其分子特性為開發(fā)新型治療策略提供了關鍵靶點。
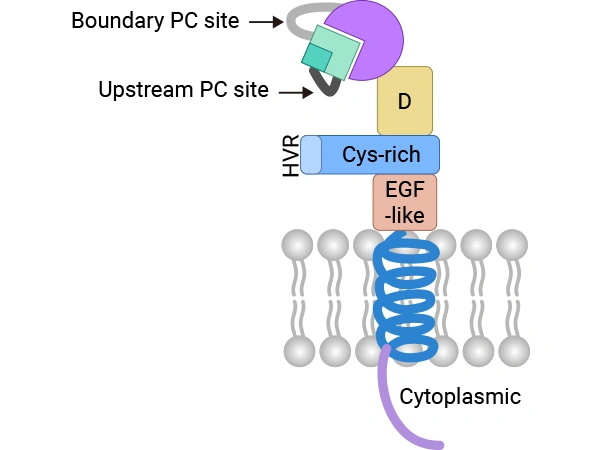
圖. ADAM9錨定在膜上時的C型結(jié)構(gòu)
來源:doi:10.3390/ijms21207790
2. ADAM9在疾病發(fā)展中的多重角色與機制
ADAM9作為一種多功能跨膜蛋白,不僅在腫瘤中有重要作用,也在多種免疫與炎癥性疾病中發(fā)揮關鍵調(diào)控作用,影響炎癥反應、免疫細胞功能及疾病進展。其獨特的結(jié)構(gòu)特征使其能夠參與復雜的信號網(wǎng)絡調(diào)控,通過酶活性和非酶活性兩種機制影響多個關鍵信號通路。
2.1 ADAM9在癌癥信號通路中的核心調(diào)控機制
在AKT信號通路調(diào)控中,ADAM9展現(xiàn)出精細的分子調(diào)控機制。其金屬蛋白酶結(jié)構(gòu)域能夠特異性識別并切割多種膜結(jié)合前體蛋白,包括生長因子受體配體。例如,在口腔癌和乳腺癌研究中 [2][3],ADAM9通過調(diào)控HB-EGF的脫落過程,影響EGFR家族的活化狀態(tài),進而激活下游PI3K/AKT信號軸。更重要的是,ADAM9還能通過其解整合素結(jié)構(gòu)域與整合素家族成員發(fā)生特異性相互作用,這種相互作用能夠改變整合素的構(gòu)象和功能狀態(tài),進而影響FAK/Src信號復合物的組裝和活化 [4]。
在NF-κB通路調(diào)控方面,ADAM9表現(xiàn)出更為復雜的多層次控制能力。除了通過蛋白酶活性切割TNF家族前體蛋白外,ADAM9還能直接與IKK復合物中的重要調(diào)節(jié)亞基發(fā)生相互作用。這種直接相互作用可能影響IKK復合物的亞細胞定位和活化動力學 [3]。研究還發(fā)現(xiàn),ADAM9參與調(diào)控NF-κB與HIF-1α信號通路的交叉對話,這種交叉調(diào)控在腫瘤適應缺氧微環(huán)境中發(fā)揮關鍵作用 [5]。
ADAM9在腫瘤血管生成中的調(diào)控作用表現(xiàn)出顯著的時空特異性。它不僅通過切割和釋放VEGF家族成員直接促進血管生成,還能通過調(diào)控Angiopoietin-Tie2信號系統(tǒng)影響血管穩(wěn)定性 [3][4]。在胰腺癌研究中,ADAM9的表達水平與血管成熟度呈負相關,提示其可能通過破壞血管正常化過程促進腫瘤惡性進展 [4]。
此外,ADAM9可通過影響多個關鍵信號節(jié)點協(xié)調(diào)上皮-間質(zhì)轉(zhuǎn)化(EMT)的調(diào)控過程 [6]。除了傳統(tǒng)的TGF-β和Wnt信號通路外,ADAM9還參與調(diào)控Hippo信號通路效應分子YAP/TAZ的核質(zhì)穿梭。這種調(diào)控可能通過影響細胞機械感應信號來實現(xiàn),因為ADAM9與整合素的相互作用能夠改變細胞對細胞外基質(zhì)硬度的感知能力。
在治療抵抗機制方面,ADAM9通過建立復雜的反饋調(diào)控網(wǎng)絡影響腫瘤細胞的應激反應 [3] [7]。在DNA損傷應答中,ADAM9不僅影響ATM/ATR信號通路的活化,還能通過調(diào)控CHK1/2的磷酸化狀態(tài)影響細胞周期檢查點功能。在凋亡調(diào)控中,ADAM9通過影響B(tài)cl-2家族蛋白的磷酸化修飾和亞細胞定位,精細調(diào)節(jié)線粒體外膜通透性 [7]。
2.2 ADAM9在免疫細胞調(diào)控與炎癥反應中發(fā)揮關鍵調(diào)控作用
ADAM9可通過與整合素(如αvβ3、α9β1)結(jié)合,激活PI3K/Akt和MAPK信號通路,促進中性粒細胞的激活和趨化,增強其炎癥反應能力。這一過程還涉及CXCR2信號的協(xié)同調(diào)控,提示ADAM9在炎癥相關疾病(如腫瘤微環(huán)境、慢性炎癥)中促進免疫細胞遷移和激活 [8]。
ADAM9還可通過剪切多種膜結(jié)合蛋白(如MICA、TNF-α和IL-6R)破壞免疫監(jiān)視。例如,ADAM9介導MICA的脫落,產(chǎn)生可溶性MICA(sMICA),后者作為免疫誘餌抑制NK細胞介導的腫瘤細胞清除,從而促進肝癌和結(jié)直腸癌等疾病的免疫逃逸 [9]。此外,ADAM9在慢性肝炎和非酒精性脂肪性肝炎(NASH)中通過調(diào)控IL-6等炎癥因子,加劇纖維化和癌變進程。
3. ADAM9的藥物研發(fā)現(xiàn)狀
ADAM9是一種在生理和病理狀態(tài)下都具有多重功能的關鍵蛋白。特別是在癌癥領域,它通過蛋白酶依賴和非依賴的多種途徑驅(qū)動腫瘤惡化,因此,ADAM9成為了藥物開發(fā)的一個潛在靶點。目前靶向ADAM9的在研藥物類型主要為ADC,適應癥多為實體腫瘤。以下是ADAM9在研ADC管線:
| 藥物 | 藥物類型 | 適應癥 | 在研機構(gòu) | 最高研發(fā)階段 |
|---|---|---|---|---|
| AEX-6003 | ADC | 腫瘤 | ImmunoGen | 臨床前 |
| DB1317 | ADC | 晚期惡性實體瘤,去勢抵抗性前列腺癌 | 映恩生物制藥(蘇州) | 臨床1期 |
| MGC-028 | ADC | 晚期惡性實體瘤,大腸腺癌、膽管癌、結(jié)直腸癌、非小細胞癌等 | MacroGenics | 臨床1期 |
| IMGC-936 | ADC | 晚期惡性實體瘤 | MacroGenics, ImmunoGen | 臨床1/2期 |
(數(shù)據(jù)來源于Pharmsnap)
4. 相關產(chǎn)品推薦
● ADAM9重組蛋白
(Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
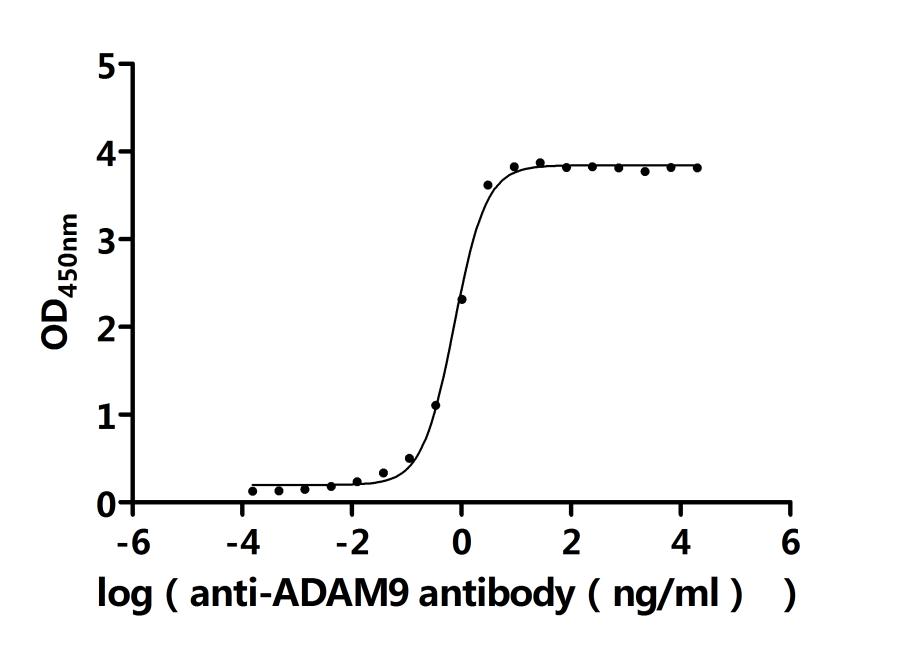
Activity: Measured by its binding ability in a functional ELISA. Immobilized Human ADAM9 at 2μg/ml can bind Anti-ADAM9 recombinant antibody (CSB-RA618774MA1HU). The EC50 is 0.9401-1.088 ng/mL.
Recombinant Macaca fascicularis ADAM9 metallopeptidase domain 9 (ADAM9), Partial,
(CSB-MP7133MOVd7)

(Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
(Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
● ADAM9抗體
ADAM9 Antibody (CSB-PA618774ESR1HU)
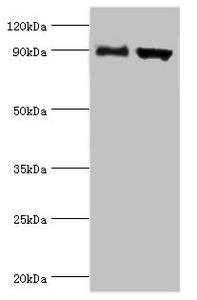
Western blot
All lanes: Disintegrin and metalloproteinase domain-containing protein 9 antibody at 2μg/ml
Lane 1: Mouse liver tissue
Lane 2: Mouse heart tissue
Secondary
Goat polyclonal to rabbit IgG at 1/10000 dilution
Predicted band size: 91,73 kDa
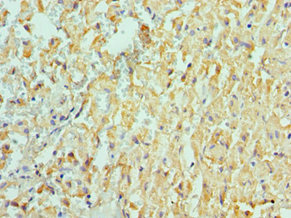
Immunohistochemistry of paraffin-embedded human liver cancer using CSB-PA618774ESR1HU at dilution of 1:100
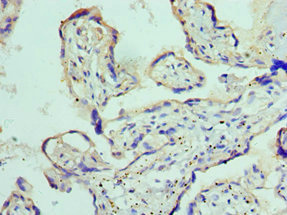
Immunohistochemistry of paraffin-embedded human placenta tissue using CSB-PA618774ESR1HU at dilution of 1:100
● ADAM9 ELISA試劑盒
參考文獻:
[1] Chou, C. W., Huang, Y. K., Kuo, T. T., Liu, J. P., & Sher, Y. P. (2020). An Overview of ADAM9: Structure, Activation, and Regulation in Human Diseases. International journal of molecular sciences, 21(20), 7790.
[2] Buranaphatthana, W., Wu, S., Makeudom, A., Sastraruji, T., Supanchart, C., & Krisanaprakornkit, S. (2021). Involvement of the A disintegrin and metalloproteinase 9 in oral cancer cell invasion.. European journal of oral sciences, e12775 .
[3] Zhou, R., Cho, W., , V., Cheuk, W., So, Y., Wong, S., Zhang, M., Li, C., Sun, Y., Zhang, H., Chan, L., & Tian, M. (2020). ADAM9 Mediates Triple-Negative Breast Cancer Progression via AKT/NF-κB Pathway. Frontiers in Medicine, 7.
[4] Oria, V., Lopatta, P., Schmitz, T., Preca, B., Nystr?m, A., Conrad, C., Bartsch, J., Kulemann, B., Hoeppner, J., Maurer, J., Bronsert, P., & Schilling, O. (2019). ADAM9 contributes to vascular invasion in pancreatic ductal adenocarcinoma. Molecular Oncology, 13, 456 - 479.
[5] Zhu, L., Zhao, Y., Yu, L., He, X., Wang, Y., Jiang, P., Yu, R., Li, W., Dong, B., Wang, X., & Dong, Y. (2021). Overexpression of ADAM9 decreases radiosensitivity of hepatocellular carcinoma cell by activating autophagy. Bioengineered, 12, 5516 - 5528.
[6] Moriwaki, M., Le, T., Sung, S., Jotatsu, Y., Yang, Y., Hirata, Y., Ishii, A., Chiang, Y., Chen, K., Shigemura, K., & Fujisawa, M. (2022). Relevance of A Disintegrin and Metalloproteinase Domain-Containing (ADAM)9 Protein Expression to Bladder Cancer Malignancy. Biomolecules, 12.
[7] Ueno, M., Shiomi, T., Mochizuki, S., Chijiiwa, M., Shimoda, M., Kanai, Y., Kataoka, F., Hirasawa, A., Susumu, N., Aoki, D., & Okada, Y. (2018). ADAM9 is over‐expressed in human ovarian clear cell carcinomas and suppresses cisplatin‐induced cell death. Cancer Science, 109, 471 - 482.
[8] Amêndola, R., Martin, A., Selistre-De-Araújo, H., Paula-Neto, H., Saldanha-Gama, R., & Barja-Fidalgo, C. (2015). ADAM9 disintegrin domain activates human neutrophils through an autocrine circuit involving integrins and CXCR2. Journal of Leukocyte Biology, 97.
[9] Arai, J., Otoyama, Y., Nozawa, H., Kato, N., & Yoshida, H. (2022). The immunological role of ADAMs in the field of gastroenterological chronic inflammatory diseases and cancers: a review. Oncogene, 42, 549 - 558.