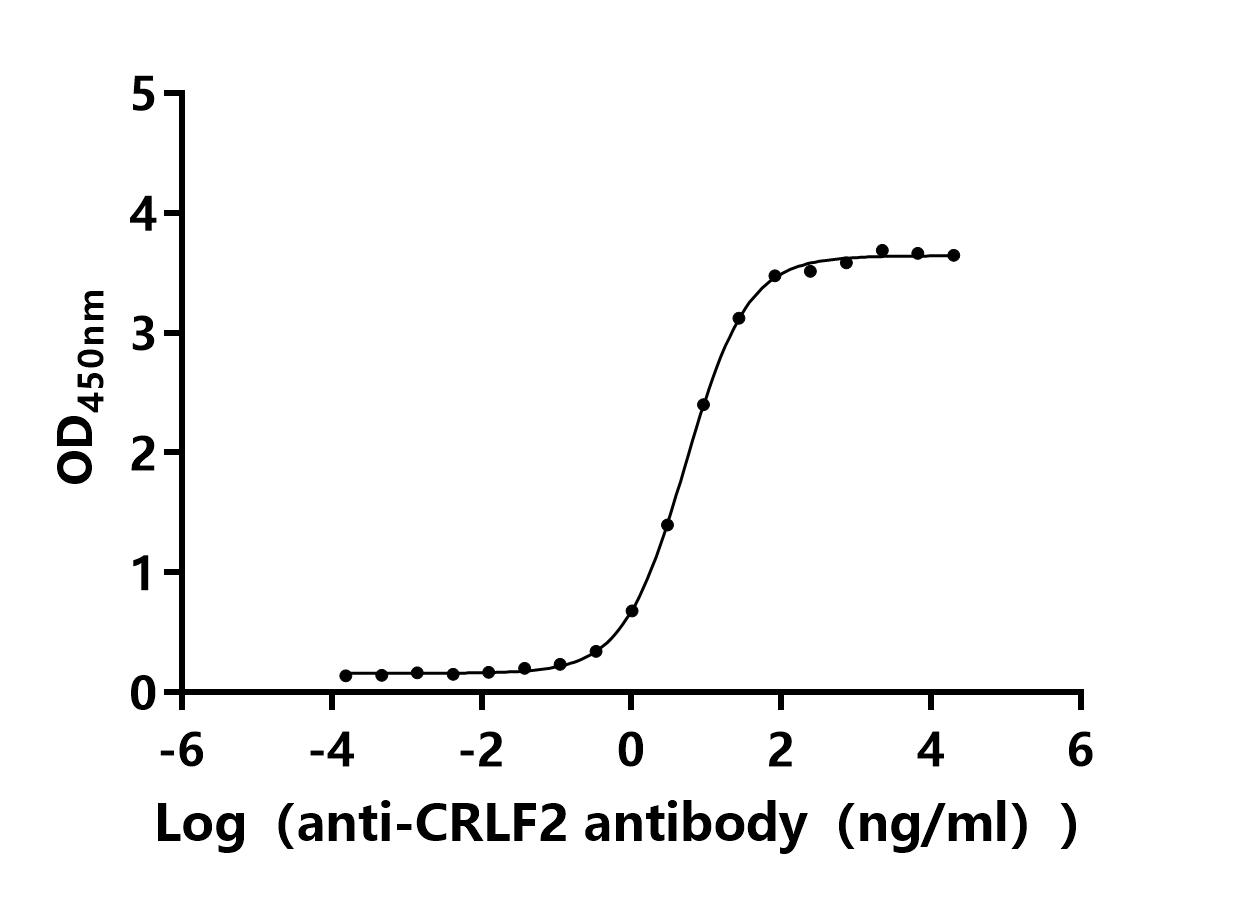
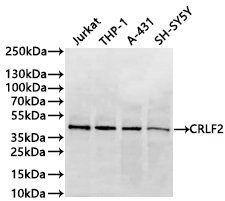
CRLF2(TSLPR): 連接2型炎癥與血液腫瘤的關鍵靶點
日期:2025-12-08 13:09:16
胸腺基質淋巴細胞生成素受體(TSLPR,又稱CRLF2)是介導上皮源性細胞因子TSLP信號傳導的關鍵受體亞單位,與IL-7Rα共同構成功能性受體復合物。TSLP/TSLPR通路在調控2型炎癥反應中處于上游樞紐位置,不僅參與哮喘、慢性鼻竇炎伴鼻息肉(CRSwNP)和慢性阻塞性肺疾病(COPD)等免疫介導性疾病的發病機制,還在Ph樣急性淋巴細胞白血病等血液腫瘤中因異常激活而驅動疾病進展。
近年來,隨著對TSLPR生物學功能的深入理解,該靶點逐漸成為連接炎癥與腫瘤治療的重要橋梁。其中,全球目前唯一處于臨床開發階段的TSLP受體拮抗劑Verekitug(UPB-101),在2025年取得了關鍵性突破,進一步凸顯了該靶點在慢性氣道炎癥性疾病中的治療潛力。
1. CRLF2的結構和功能基礎
CRLF2(cytokine receptor-like factor 2),又稱胸腺基質淋巴細胞生成素受體(TSLPR),是I型細胞因子受體超家族成員,編碼該蛋白的基因位于X和Y染色體的假常染色體1區(PAR1)。CRLF2本身不具激酶活性,需與白介素-7受體α鏈(IL-7Rα)形成異源二聚體,共同構成胸腺基質淋巴細胞生成素(TSLP)的功能性高親和力受體復合物 [1]。
1.1 蛋白結構域組成
CRLF2為I型跨膜糖蛋白,由約370個氨基酸組成,包含一個N端胞外結構域、一個單次跨膜區和一個C端短胞內尾部。其胞外區含有I型細胞因子受體家族標志性WSXWS基序,對維持受體構象及配體結合至關重要。然而,與典型I型受體相比,CRLF2結構具有明顯非典型性:其胞外結構域缺失四個保守半胱氨酸殘基中的第二個,可能影響二硫鍵形成與整體折疊;胞內區雖保留Box1基序(用于JAK激酶錨定),卻缺乏經典的Box2結構域;此外,其胞內尾部僅含一個酪氨酸殘基,位于羧基末端上游第4位,且該位點在配體結合后并不發生磷酸化。這些特征表明,CRLF2自身無法獨立完成完整的信號轉導,必須依賴共受體提供功能補償。
1.2 受體復合物組裝與配體識別
CRLF2自身無法獨立傳導信號,必須與IL-7Rα共表達并形成異源二聚體,方能高親和力結合TSLP。TSLP首先與CRLF2的D1結構域結合,誘導構象變化后招募IL-7Rα,最終形成穩定的三元復合物。這一組裝機制不僅實現了高親和力配體識別,還確保了信號激活的時空精確性,避免非特異性免疫激活。
2. CRLF2的相關信號通路
2.1 非經典的JAK-STAT激活機制
TSLP結合CRLF2/IL-7Rα復合物后,可誘導下游信號級聯。傳統觀點認為該過程涉及JAK1(結合IL-7Rα)與JAK2(結合CRLF2)的反式磷酸化,進而激活STAT5。然而,深入研究表明,TSLP誘導的STAT5活化并不依賴典型的JAK激酶活性——顯性負性JAK1或JAK2無法阻斷該過程,而Tec家族激酶的抑制則可部分削弱STAT5磷酸化,提示Tec激酶可能在該通路中發揮關鍵作用。此外,STAT5的激活與其驅動的細胞增殖功能并非線性耦合:STAT5活化不依賴CRLF2胞內唯一的酪氨酸殘基,而該位點對細胞增殖卻至關重要。
2.2 多通路協同調控細胞命運
除STAT5外,TSLP/CRLF2信號還可激活多條平行通路。Src家族激酶參與調控細胞增殖,其抑制劑可顯著阻斷TSLP誘導的增殖反應,但不影響STAT5磷酸化。同時,該通路亦可激活MAPK/ERK和PI3K/AKT/mTOR通路,分別調控細胞周期進程與抗凋亡程序。在病理狀態下,如Ph-like急性淋巴細胞白血病中,CRLF2的異常表達或突變可導致這些通路持續活化,共同驅動白血病克隆的擴增與存活。
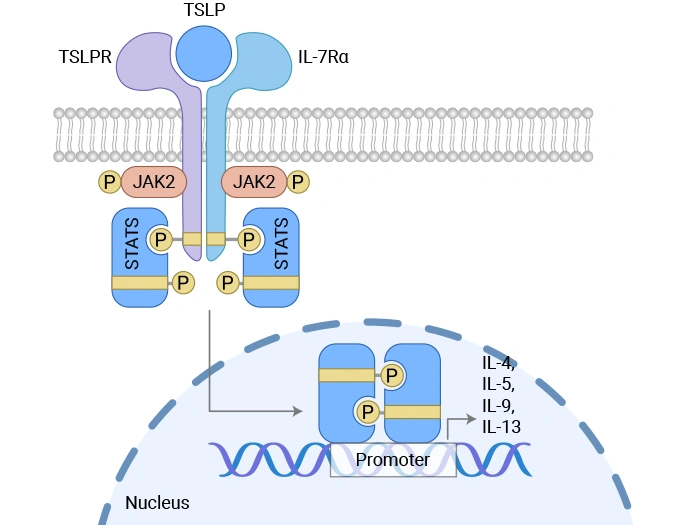
圖. 胸腺基質淋巴細胞生成素誘導信號傳導的機制 [2]
3. CRLF2與疾病
● CRLF2與Ph樣急性淋巴細胞白血病
CRLF2異常是費城染色體樣急性淋巴細胞白血病(Philadelphia chromosome–like acute lymphoblastic leukemia, Ph-like ALL)中最常見且最具臨床意義的分子特征之一。Ph-like ALL 是一種高危B細胞前體急性淋巴細胞白血病(BCP-ALL)亞型,其基因表達譜與費城染色體陽性(Ph+)ALL相似,但缺乏BCR-ABL1融合基因,取而代之的是多種激酶通路激活的遺傳改變,其中CRLF2重排或過表達占比最高 [3]。臨床上,CRLF2高表達與初診高白細胞計數、誘導治療后微小殘留病(MRD)清除不佳、復發風險升高及生存率下降顯著相關 [4]。目前,CRLF2已被納入國際ALL診療指南作為Ph-like ALL的核心診斷標志,并成為靶向治療的重要突破口
● CRLF2與哮喘
在哮喘,尤其是重度嗜酸性或Th2高型哮喘中,氣道上皮細胞因環境刺激(如過敏原、病毒、污染物)損傷而大量分泌TSLP。TSLP通過結合樹突狀細胞、2型固有淋巴細胞(ILC2s)和Th2細胞表面的CRLF2/IL-7Rα復合物,激活STAT5/STAT3通路,促進IL-4、IL-5、IL-13等2型細胞因子釋放,驅動嗜酸性粒細胞浸潤、氣道高反應性和黏液高分泌。臨床研究顯示,哮喘患者支氣管活檢組織和血清中TSLP及CRLF2表達水平顯著升高,且與疾病嚴重程度正相關 [5]。
● CRLF2與過敏
TSLP作為過敏性炎癥級聯反應的上游關鍵因子,通過其受體TSLPR(CRLF2)激活樹突狀細胞、Th2細胞和ILC2,驅動2型免疫應答;研究顯示,新型抗TSLPR全人源單克隆抗體ASP7266可有效阻斷TSLP信號傳導,抑制TSLP誘導的細胞增殖、趨化因子CCL17釋放、Th2分化及ILC2來源的IL-5產生,并在食蟹猴模型中完全抑制過敏性皮膚反應,展現出優于或媲美tezepelumab的臨床前藥理活性,有望成為哮喘、慢性鼻竇炎伴鼻息肉和特應性皮炎等過敏性疾病的新一代靶向治療選擇 [6]。
4. CRLF2靶向藥物研究進展
當前針對TSLPR(即CRLF2)靶點的在研藥物涵蓋多種藥物類型,包括單克隆抗體、抗體偶聯藥物(ADC)和雙特異性抗體(BsAb)。在過敏炎癥性疾病領域,以阻斷配體-受體相互作用為核心的單克隆抗體(如處于臨床2期的Verekitug)進展較快;而在血液腫瘤(尤其是Ph樣急性淋巴細胞白血病)領域,研發聚焦于通過抗體偶聯藥物和雙特異性抗體等新型技術實現靶向細胞殺傷,但目前多項在研項目尚處于臨床前探索階段,整體轉化進程仍屬早期。
| 藥物 | 靶點 | 藥物類型 | 在研適應癥 | 在研機構 | 最高研發階段 |
|---|---|---|---|---|---|
| Verekitug | TSLPR | 單克隆抗體 | 慢性阻塞性肺疾病、重度哮喘、慢性鼻竇炎伴鼻息肉 | Upstream Bio, Inc. | 臨床2期 |
| AM E3-SG3249 | TSLPR | ADC | Ph樣急性淋巴細胞白血病 | IRBM SpA | 臨床前 |
| CRLF2-DM1 | TSLPR x Tubulin | ADC | Ph樣急性淋巴細胞白血病 | The University of New South Wales | 臨床前 |
| 1B7/CD3 BsAb(MD Anderson) | CD3 x TSLPR | 雙特異性抗體 | 急性淋巴細胞白血病 | The University of Texas MD Anderson Cancer Center | 臨床前 |
| Anti TSLP antibody | TSLPR | 單克隆抗體 | 自身免疫性疾病 | 華潤生物醫藥有限公司 | 臨床前 |
(數據截止到2025年11月20日,來源于synapse)
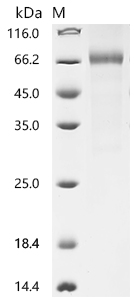
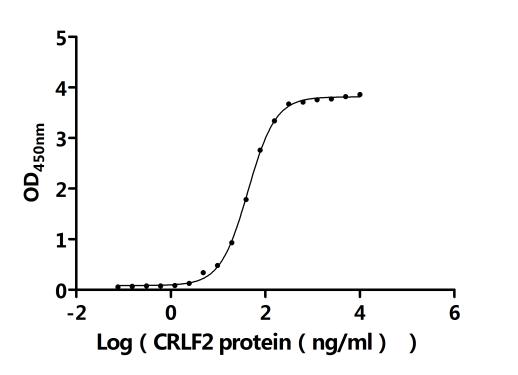
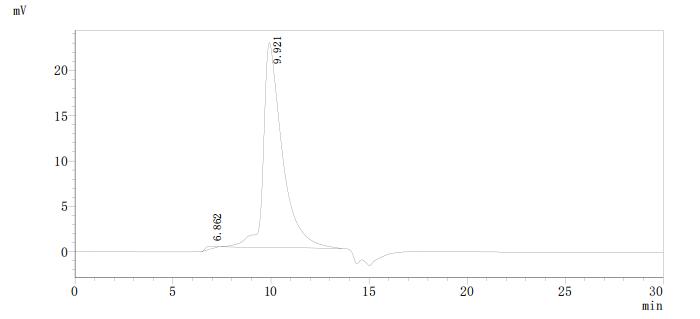
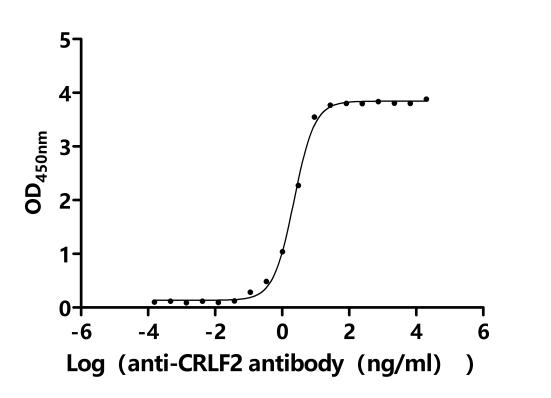
5. CRLF2研究工具
參考文獻:
[1] Liu Y J, Soumelis V, Watanabe N, et al. TSLP: an epithelial cell cytokine that regulates T cell differentiation by conditioning dendritic cell maturation. Annu Rev Immunol. 2007; 25: 193-219.
[2] Ebina-Shibuya R,Leonard W J. Role of thymic stromal lymphopoietin in allergy and beyond. Nat Rev Immunol. 2023;23 (1):24-37.
[3] Potter N, Jones L, Blair H, et al. Single-cell analysis identifies CRLF2 rearrangements as both early and late events in Down syndrome and non-Down syndrome acute lymphoblastic leukaemia. Leukemia. 2019;33 (4):893-904.
[4] Jiang M, Zou X, Lu L. Potential efficacy and prognosis of silencing the CRLF2?mediated AKT/mTOR pathway in pediatric acute B?cell lymphoblastic leukemia. Oncol Rep. 2019;41 (2):885-894.
[5] Malik B, McKerrow R, Harrington J, et al. ILC2 cells from severe allergic and eosinophilic asthma demonstrate increased expression of TSLP receptor (TSLPR) and enhanced proliferative capacity. Eur Respir J. 2021;58(suppl 65):PA823.
[6] Numazaki M, Abe M, Hanaoka K, et al. ASP7266, a Novel Antibody against Human Thymic Stromal Lymphopoietin Receptor for the Treatment of Allergic Diseases. J Pharmacol Exp Ther. 2022;380 (1):26-33.
上一篇: ADAM9:超越蛋白水解的多功能調控因子
下一篇: FCGR3A:免疫調節的關鍵受體