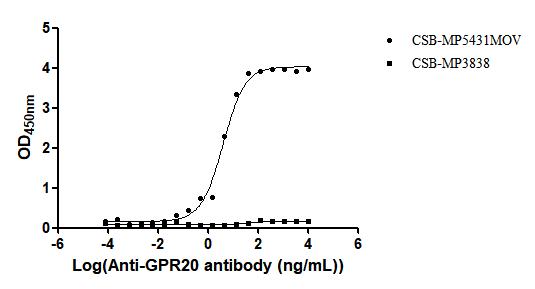
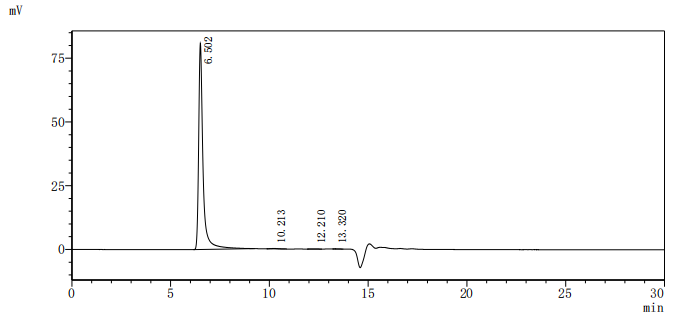
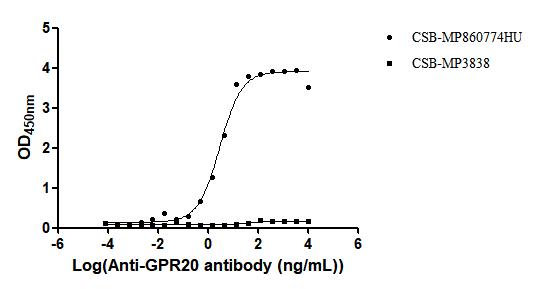
GPR20:從“孤兒”到攻克耐藥GIST的潛力新靶點
日期:2025-11-12 09:54:30
在腫瘤治療領域,攻克耐藥性始終是研究者們面臨的嚴峻挑戰。GPR20,一個長期沉寂的“孤兒”GPCR,正因其在耐藥性胃腸道間質瘤(GIST)中的獨特表現而嶄露頭角。本文將帶您深入了解GPR20如何從其神秘的“孤兒”身份,一步步成為對抗耐藥GIST的潛力新靶點,并揭示其背后的信號機制及靶向藥物研發的最新突破,為未來腫瘤治療帶來新的希望。
1. GPR20——一個新興的G蛋白偶聯受體靶點
G蛋白偶聯受體(GPCRs)是細胞膜上最大的受體家族,參與多種生理過程并是重要的藥物靶點。在這些受體中,大約有140個被稱為孤兒GPCRs的成員,其內源性配體尚未被發現,具有巨大的藥物開發潛力。GPR20作為一個新興的A類孤兒GPCR,因其獨特的組成型活性和在多種生理病理過程中的潛在作用,逐漸引起了廣泛關注 [1]。
研究顯示,GPR20通過組成型激活Gi/o蛋白,導致細胞內環磷酸腺苷(cAMP)水平降低,并可能通過調控細胞周期信號抑制細胞增殖。其高基礎活性的分子機制已通過冷凍電鏡技術解析,發現其獨特的N端螺旋帽結構在激活中發揮關鍵作用,并且正構口袋中未識別的電子密度提示了內源性配體的存在 [1]。
在疾病領域,GPR20被鑒定為胃腸道間質瘤(GIST)的新型非激酶治療靶點,尤其是在對酪氨酸激酶抑制劑(TKIs)耐藥的GIST中表現出差異性高表達 [2]。基于此,靶向GPR20的抗體偶聯藥物DS-6157a被開發,并在臨床前模型中展現出依賴GPR20表達的抗腫瘤活性,對TKI耐藥的GIST有效 [2]。
2. GPR20的背景與初步鑒定
GPR20作為孤兒GPCR,最初是通過基因組DNA中的聚合酶鏈式反應(PCR)被發現的。其序列分析顯示與核苷酸或脂質受體有高度同源性,但早期研究尚未明確其內源性配體和生理功能[1]。GPR20的組成型活性使其成為一個有趣的研究對象,即使在沒有已知配體的情況下,GPR20仍能持續激活Gi/o蛋白,進而影響cAMP水平 [2]。進一步的研究表明,GPR20通過Gi/o蛋白的激活,抑制了腺苷酸環化酶(AC)的活性,從而降低了cAMP水平,進而可能影響細胞增殖和其他生理功能 [2]。
3. GPR20的研究機制與信號通路
GPR20具有顯著的組成型活性,即在沒有已知配體的情況下也能激活偶聯的G蛋白。這一特性使其在細胞生理中扮演了獨特角色。本章將深入探討GPR20如何通過Gi/o蛋白途徑調控下游信號,尤其是其對cAMP水平的抑制作用及其對細胞增殖的影響 [2]。
3.1 GPR20的組成型活性與Gi/o蛋白偶聯
GPR20的組成型活性在多種細胞系中均得到了驗證。例如,在HEK293細胞中,GPR20過表達會顯著降低cAMP水平,同時增加GTPγS的結合量,這表明GPR20能夠自發激活Gi/o蛋白 [2]。這一機制可以通過百日咳毒素(PTX)抑制,進一步證實了Gi/o蛋白在其作用中的關鍵角色。實驗還發現,GPR20中的DRY基序對于G蛋白的激活至關重要 [2]。
3.2 GPR20的結構生物學解析
最近,通過低溫電子顯微鏡(cryo-EM)技術,研究人員成功解析了GPR20與Gi蛋白復合體的結構,揭示了其組成型活性背后的分子機制 [1]。其中,GPR20獨特的N端螺旋帽結構穩定了其活化構象,使得GPR20能夠在沒有配體的情況下持續激活Gi/o蛋白 [1]。此外,結構分析還揭示了GPR20的正構口袋中未分配的電子密度,提示可能存在內源性配體或重要的調控分子 [1]。
3.3 GPR20的細胞功能與配體探索
GPR20的組成型激活影響細胞內cAMP水平及有絲分裂信號,抑制細胞增殖。研究還發現,GPR20的高基礎活性可能是其在細胞生理中發揮作用的關鍵。進一步探索其內源性配體的身份,將為理解GPR20的生物學功能提供重要線索 [1]。
4. GPR20與相關疾病:以胃腸道間質瘤(GIST)為例
胃腸道間質瘤(GIST)是胃腸道最常見的間充質腫瘤,治療上主要依賴酪氨酸激酶抑制劑(TKIs)。然而,TKI耐藥性是導致GIST治療失敗的主要原因之一。因此,尋找新的靶點對克服TKI耐藥具有重要意義 [3]。
4.1 GPR20在GIST中的作用
GPR20在GIST中的高表達使其成為一個潛在的治療靶點。研究表明,在GIST細胞系和患者來源異種移植(PDX)模型中,GPR20的表達顯著增加 [3]。基于這一發現,研究者開發了靶向GPR20的抗體藥物偶聯物(ADC)DS-6157a,該藥物在臨床前模型中表現出依賴GPR20表達的抗腫瘤活性,對TKI耐藥的GIST有效 [3]。
4.2 GPR20在GIST中的臨床前研究
DS-6157a的臨床前研究表明,該藥物在多種GIST模型中具有顯著的抗腫瘤活性,尤其對伊馬替尼、舒尼替尼和瑞戈非尼耐藥的GIST模型展現出優異效果 [3]。此外,DS-6157a的藥代動力學特性也已在早期臨床研究中得到了初步評估 [4]。
5. GPR20靶向藥物的最新研究進展
DS-6157a代表了靶向GPR20的首個抗體藥物偶聯物(ADC),其設計旨在克服GIST對TKI治療的耐藥性。該藥物由抗GPR20抗體、可酶切連接子和拓撲異構酶I抑制劑載荷DXd組成,能夠在GIST異種移植模型中依賴GPR20表達發揮抗腫瘤作用 [3]。
DS-6157a的臨床前評估顯示其對TKI耐藥的GIST模型具有顯著抗腫瘤活性。此外,早期臨床試驗表明,DS-6157a的藥代動力學特性與安全性之間存在明顯的關系,藥物暴露量與中性粒細胞減少癥和血小板減少癥等血液學不良事件相關 [4]。
6. GPR20研究工具
GPR20作為孤兒GPCR,其組成型活性及在GIST等疾病中的潛力,推動了針對該受體的靶向治療研究。盡管目前的研究仍在早期階段,但DS-6157a等新型藥物已展示了GPR20作為治療靶點的巨大潛力。華美生物提供GPR20重組蛋白、抗體產品,助力您進一步探索GPR20的內源性配體及其在更多疾病中的作用,推動GPR20靶向療法的臨床應用。
參考文獻:
[1] Xi Lin, Shan Jiang, Yiran Wu, Xiaohu Wei, G. Han, Lijie Wu, Junlin Liu, Bo Chen, Zhibin Zhang, Suwen Zhao, V. Cherezov, Fei Xu.(2023). The activation mechanism and antibody binding mode for orphan GPR20.
[2] Momoko Hase, T. Yokomizo, Takao Shimizu, Motonao Nakamura.(2008). Characterization of an Orphan G Protein-coupled Receptor, GPR20, That Constitutively Activates Gi Proteins*.
[3] K. Iida, A. A. Abdelhamid Ahmed, A. Nagatsuma, T. Shibutani, Satoru Yasuda, Michiko Kitamura, C. Hattori, Manabu Abe, J. Hasegawa, Takuma Iguchi, Tsuyoshi Karibe, T. Nakada, K. Inaki, Reiko Kamei, Yuki Abe, T. Nomura, J. Andersen, S. Santagata, Matthew L. Hemming, S. George, T. Doi, A. Ochiai, G. Demetri, T. Agatsuma.(2021). Identification and Therapeutic Targeting of GPR20, Selectively Expressed in Gastrointestinal Stromal Tumors, with DS-6157a, a First-In-Class Antibody-Drug Conjugate.
[4] Brittany P Tran, Maura Fallon, Kristin Follman, Sergio Iadevaia, Madan Kundu, A. Laadem, Yvonne Lau, Satoshi Nishioka, Julia Shi, Xinyuan Zhang. Population pharmacokinetics and exposure-safety of DS-6157a in patients with advanced gastrointestinal stromal tumor (GIST).
下一篇: IL1RAP:炎癥與腫瘤治療的新興靶點