FLT1(VEGFR-1):血管生成的雙向調(diào)節(jié)器與疾病治療新靶點
日期:2025-10-20 13:24:58
血管內(nèi)皮生長因子受體(VEGFR)家族一直是熱門靶點,其中,F(xiàn)LT1(VEGFR-1)以其獨特的“雙向調(diào)控”角色脫穎而出。FTL1遠(yuǎn)非一個簡單的信號接收器,它既能通過膜結(jié)合形式傳遞信號,促進內(nèi)皮細(xì)胞遷移與血管重塑;也能通過其可溶性形式sFLT1“捕獲”配體,負(fù)反饋抑制血管過度增生,從而在促血管生成與抗血管生成之間維持著至關(guān)重要的動態(tài)平衡。
近年研究表明,這一平衡的打破直接參與肝纖維化、肺損傷修復(fù)障礙、骨關(guān)節(jié)炎乃至腫瘤進展等多種病理過程。隨著其在免疫調(diào)節(jié)與藥物耐藥中的新角色被不斷揭示,F(xiàn)LT1已成為一個極具潛力的疾病治療新靶點,吸引著從基礎(chǔ)科研到藥物研發(fā)的廣泛關(guān)注。本文將系統(tǒng)梳理FLT1的生物學(xué)功能、信號網(wǎng)絡(luò)及其在相關(guān)疾病中的最新研究進展。
1. FLT1的背景介紹
1.1 生物學(xué)特性與功能
FLT1(VEGFR-1)是血管內(nèi)皮生長因子受體(VEGFR)家族成員,屬于典型Ⅲ型受體酪氨酸激酶。其結(jié)構(gòu)包括7個胞外免疫球蛋白樣結(jié)構(gòu)域、單次跨膜區(qū)及胞內(nèi)酪氨酸激酶結(jié)構(gòu)域 [1]。通過可選擇性剪接產(chǎn)生的可溶性FLT1(sFLT1)缺乏跨膜及激酶結(jié)構(gòu)域,但保留VEGF結(jié)合能力,是內(nèi)源性VEGF信號拮抗劑 [2]。晶體結(jié)構(gòu)顯示,F(xiàn)LT1與VEGF-A形成1:2復(fù)合物,其中第二免疫球蛋白樣結(jié)構(gòu)域(D2)決定配體識別,而D3參與受體二聚化激活 [3]。FLT1對VEGF家族配體呈差異親和力,對VEGF-B和胎盤生長因子(PlGF)的結(jié)合高于VEGFR-2。
在血管生成過程中,F(xiàn)LT1通過雙重機制發(fā)揮調(diào)控作用:膜結(jié)合型FLT1激活后招募Gab1,進而激活PI3K-Akt-mTOR通路,促進內(nèi)皮細(xì)胞遷移 [4];而sFLT1通過中和游離VEGF抑制血管過度增生,維持血管穩(wěn)態(tài) [1]。研究表明,F(xiàn)LT1敲除小鼠因血管發(fā)育異常導(dǎo)致胚胎致死,其表型與VEGFR-2缺陷明顯不同 [2]。FLT1激酶結(jié)構(gòu)域第1210位酪氨酸磷酸化可特異性激活HIF-1α-VEGF正反饋環(huán)路,在低氧環(huán)境下放大促血管生成信號 [4]。此外,F(xiàn)LT1通過非經(jīng)典途徑調(diào)控Rho GTPases活性,影響內(nèi)皮骨架重組與管腔形成 [3]。
FLT1的功能依賴動態(tài)糖基化修飾。N-連接糖基化影響受體膜定位,并通過調(diào)節(jié)配體結(jié)合親和力控制信號強度。病理條件下,金屬蛋白酶ADAM17介導(dǎo)的FLT1胞外域脫落產(chǎn)生sFLT1片段,該過程受TNF-α和氧化應(yīng)激顯著誘導(dǎo) [1]。FLT1在特定組織中表現(xiàn)出血管生成非依賴性功能,如在神經(jīng)元中激活TrkB通路調(diào)節(jié)突觸可塑性,在軟骨細(xì)胞中抑制MMP-13表達延緩基質(zhì)降解 [3][4]。這一多功能性使FLT1成為血管系統(tǒng)與微環(huán)境的重要連接節(jié)點。
1.2 在VEGF家族中的定位
血管內(nèi)皮生長因子(VEGF)家族包括VEGF-A、VEGF-B、VEGF-C、VEGF-D及胎盤生長因子(PlGF),其受體為FLT1(VEGFR-1)、KDR(VEGFR-2)及FLT4(VEGFR-3)[5]。FLT1是首個鑒定的VEGF受體,對VEGF-B和PlGF結(jié)合特異性高于VEGFR-2,但激酶活性較弱,主要發(fā)揮調(diào)控作用 [1]。
FLT1與VEGFR-2互補調(diào)控血管生成:VEGFR-2介導(dǎo)內(nèi)皮增殖、遷移和通透性增加,而FLT1通過競爭性結(jié)合VEGF-A抑制VEGFR-2過度激活,或激活PLCγ-PKC-MAPK通路維持血管穩(wěn)態(tài) [5]。FLT1基因敲除小鼠因血管過度增生致死,而僅保留胞外段的截短型FLT1轉(zhuǎn)基因小鼠可正常存活,表明其負(fù)調(diào)控作用主要依賴配體捕獲機制 [3]。PlGF-FLT1軸可在病理條件下激活PI3K/Akt通路,促進血管重塑,在缺血性疾病和腫瘤血管生成中發(fā)揮關(guān)鍵作用 [6]。
FLT1與VEGFR-3協(xié)同調(diào)控血管-淋巴管平衡。VEGFR-3響應(yīng)VEGF-C/D促進淋巴管生成,而FLT1通過形成異源二聚體增強淋巴管內(nèi)皮對低濃度VEGF-C的敏感性 [1]。在傷口修復(fù)模型中,F(xiàn)LT1缺陷可導(dǎo)致淋巴管密度降低約40% [3]。sFLT1作為天然拮抗劑,通過結(jié)合循環(huán)VEGF-A和PlGF調(diào)控血管通透性,其水平異常升高與子癇前期發(fā)病相關(guān) [5]。蛋白組學(xué)顯示,sFLT1對VEGF-A165親和力是VEGFR-2的5倍,但對VEGF-A121抑制作用有限,這種亞型選擇性為血管疾病治療提供靶向策略 [2]。
1.3 FLT1表達調(diào)控機制
FLT1表達受多層級調(diào)控:
- 低氧:α結(jié)合FLT1啟動子缺氧反應(yīng)元件,上調(diào)轉(zhuǎn)錄 [7]
- 氧化應(yīng)激:ROS激活NF-κB,穩(wěn)定FLT1 mRNA,提高蛋白水平2-3倍 [8]
- 表觀遺傳:5-氮雜胞苷降低啟動子CpG島甲基化,骨髓基質(zhì)細(xì)胞中表達量提升40%
- miRNA調(diào)控:miR-206抑制FLT1翻譯,miR-210低氧條件下下調(diào),間接增強表達 [3]
- 炎癥因子:TNF-α通過p38 MAPK/NF-κB/AP-1在6小時內(nèi)誘導(dǎo)表達峰值 [7]
- 機械應(yīng)力:流體剪切力通過Piezo1觸發(fā)鈣信號,使動脈內(nèi)皮FLT1表達空間異質(zhì)性,高剪切力區(qū)域表達降低約35% [8]
- 激素調(diào)控:糖皮質(zhì)激素受體與啟動子結(jié)合抑制轉(zhuǎn)錄,Notch信號Hes1競爭結(jié)合增強子區(qū)域抑制表達 [3][4]
2. FLT1的研究機制
2.1 經(jīng)典信號通路
FLT1結(jié)合VEGF誘導(dǎo)二聚化,自磷酸化后招募Akt等銜接蛋白,形成信號復(fù)合物 [4]。
- Akt通路:抑制GSK-3β并激活mTORC1,促進內(nèi)皮存活和遷移,同時上調(diào)HIF-1α穩(wěn)定性 [8]
- HIF-1α正反饋:低氧下增強VEGF轉(zhuǎn)錄,放大血管生成信號 [9]
- PLCγ-PKC-MAPK:調(diào)控血管穩(wěn)態(tài)和遷移
VEGF刺激呈時空特異性,短期增強血管通透性,長期促進血管新生 [5]。FLT1與VEGFR-2形成異源二聚體協(xié)同調(diào)控PI3K-Akt和ERK1/2分支,Akt磷酸化水平與微血管密度正相關(guān)。TNF-α可通過NF-κB抑制HIF-1α,阻斷FLT1-VEGF正反饋循環(huán),導(dǎo)致血管生成障礙 [8]。
2.2 與其他受體協(xié)同作用
FLT1與VEGFR-2形成復(fù)合物,F(xiàn)LT1偏向PLCγ-PKC-MAPK通路,VEGFR-2偏向PI3K-Akt通路 [4]。低氧下,F(xiàn)LT1競爭性結(jié)合VEGF-B/PlGF,減少VEGFR-2過度激活,維持血管穩(wěn)態(tài) [5]。受體比例和磷酸化狀態(tài)動態(tài)平衡信號輸出,sFLT1水平變化進一步精細(xì)調(diào)控血管生成 [2][5]。在軟骨修復(fù)中,F(xiàn)LT1/VEGFR-2比例變化影響血管侵襲和MMP-9分泌,為組織工程提供有利微環(huán)境 [5]。
2.3 信號網(wǎng)絡(luò)調(diào)控模式
- 正反饋:α/FLT1增強VEGF表達 [9]
- 負(fù)反饋:sFLT1中和VEGF、PTP1B去磷酸化、c-Cbl介導(dǎo)降解 [10][11]
- 動態(tài)平衡失衡:過度激活導(dǎo)致腫瘤血管增生,過度抑制阻礙組織修復(fù) [4]
網(wǎng)絡(luò)藥理學(xué)研究顯示,天然產(chǎn)物和復(fù)方藥物可通過調(diào)節(jié)FLT1及其下游信號實現(xiàn)血管穩(wěn)態(tài)平衡 [11]。
3. FLT1相關(guān)疾病研究
3.1 肝纖維化
FLT1介導(dǎo)血管生成在肝纖維化中促進病理血管形成和細(xì)胞外基質(zhì)沉積 [9]。四氯化碳誘導(dǎo)小鼠模型中,F(xiàn)LT1表達與纖維化程度正相關(guān),抑制FLT1可降低膠原沉積和肝星狀細(xì)胞活化。PDGF/VEGF自分泌環(huán)加速肌成纖維細(xì)胞轉(zhuǎn)化,雙靶點抑制劑RC28-E可減少膠原沉積,顯示潛在治療價值 [12]。單細(xì)胞測序顯示,纖維化肝臟中FLT1+內(nèi)皮亞群與炎癥因子IL-6、TGF-β1表達高度重疊 [13]。脂毒性環(huán)境通過sFLT1上調(diào)導(dǎo)致血管功能障礙 [14]。
3.2 肺損傷修復(fù)
FLT1在肺損傷修復(fù)中表現(xiàn)雙重作用:急性期維持血管完整性,慢性期過度激活導(dǎo)致血管異常。博來霉素誘導(dǎo)模型顯示,F(xiàn)LT1上調(diào)VEGF-A促病理性毛細(xì)血管增生,RC28-E抑制TGF-β1/Smad3改善肺功能 [12]。MSC-EVs攜帶miR-214-3p抑制FLT1翻譯,促進肺泡上皮再生 [15][16]。FLT1抑制劑在損傷后7-14天干預(yù)效果最佳,可平衡促血管生成與抗纖維化需求。
3.3 軟骨損傷修復(fù)
FLT1調(diào)控軟骨下血管形成,通過HIF-1α信號促進內(nèi)皮遷移和新生血管形成 [3]。適度血管化利于干細(xì)胞遷移和營養(yǎng)供應(yīng),sFLT1通過競爭VEGF抑制過度血管化,維持軟骨-骨界面穩(wěn)態(tài) [15]。FLT1抑制可減少MMP-2/9釋放,降低基質(zhì)降解風(fēng)險 [10],結(jié)合抗FLT1抗體水凝膠支架可實現(xiàn)軟骨結(jié)構(gòu)性修復(fù) [15]。
4. FLT1靶向藥物研發(fā)
近年來,針對FLT1的靶向藥物研發(fā)取得了顯著進展,尤其在抗腫瘤免疫和耐藥逆轉(zhuǎn)方面展現(xiàn)出潛力。例如,研究發(fā)現(xiàn)FLT1的激活可通過非經(jīng)典途徑保護癌細(xì)胞免受PARP抑制劑(PARPi)的抑制。通過使用FLT1抑制劑(如阿昔替尼)或基因敲除,能夠抑制AKT信號通路,增加CD8+ T細(xì)胞浸潤,顯著逆轉(zhuǎn)PARPi耐藥性。目前有10款小分子藥物已批準(zhǔn)上市,其余部分在研管線如下表:
| 藥物 | 作用機制 | 藥物類型 | 在研適應(yīng)癥 | 在研機構(gòu) | 最高研發(fā)階段 |
|---|---|---|---|---|---|
| 德立替尼 | FGFR1拮抗劑 | FGFR2拮抗劑 | VEGFR1拮抗劑 | VEGFR2拮抗劑 | VEGFR3拮抗劑 | 小分子化藥 | 結(jié)腸癌 | 鼻咽腫瘤 | 南京愛德程醫(yī)藥科技有限公司 | 上海海和藥物研究開發(fā)股份有限公司 | 臨床3期 |
| 西地尼布 | PDGFRβ抑制劑 | VEGFR1拮抗劑 | VEGFR2拮抗劑 | VEGFR3拮抗劑 | c-Kit抑制劑 | 小分子化藥 | 卵巢子宮內(nèi)膜樣癌 | 輸卵管透明細(xì)胞腺癌 | 卵巢透明細(xì)胞腺癌 | 卵巢混合上皮癌等 | National Cancer Institute | AstraZeneca PLC | The University of Texas MD Anderson Cancer Center | 臨床3期 |
| Zanzalintinib | AXL抑制劑 | MerTK抑制劑 | VEGFR1拮抗劑 | c-Met抑制劑 | 小分子化藥 | 轉(zhuǎn)移性透明細(xì)胞性腎細(xì)胞癌 | 腎細(xì)胞癌 | 轉(zhuǎn)移性結(jié)直腸癌 | 胰腺外神經(jīng)內(nèi)分泌腫瘤等 | Exelixis, Inc. | 臨床3期 |
| 司曲替尼 | AXL抑制劑 | RET抑制劑 | Tie-2拮抗劑 | VEGFR1拮抗劑 | VEGFR2拮抗劑 | VEGFR3拮抗劑 | c-Met抑制劑 | 小分子化藥 | 腫瘤 | 晚期鱗狀非小細(xì)胞肺癌 | 轉(zhuǎn)移性非鱗狀非小細(xì)胞肺癌 | 肝轉(zhuǎn)移等 | BeOne Medicines Ltd. | Mirati Therapeutics, Inc. | 百濟神州(廣州)醫(yī)藥有限公司 | 臨床3期 |
| VEGFR-1/2 peptide vaccine(Keio University) | VEGFR1拮抗劑 | VEGFR2拮抗劑 | 通用抗原疫苗 | 合成肽疫苗 | 治療性疫苗 | 膠質(zhì)瘤 | 神經(jīng)纖維瘤病 | Keio University | 臨床2期 |
| YP-01001 | FGFRs拮抗劑 | RET抑制劑 | VEGFR1拮抗劑 | VEGFR2拮抗劑 | VEGFR3拮抗劑 | 小分子化藥 | 實體瘤 | 晚期惡性實體瘤 | 甲狀腺癌 | 重慶藥友制藥有限責(zé)任公司 | 上海復(fù)星醫(yī)藥(集團)股份有限公司 | 臨床2期 |
| CBP-4888 | VEGFR1拮抗劑 | siRNA | 先兆子癇 | Comanche Biopharma Corp. | 臨床1期 |
| Dual-targeting VEGFR1 and PD-L1 CAR-T cells(Sichuan University) | PDL1調(diào)節(jié)劑 | VEGFR1調(diào)節(jié)劑 | T淋巴細(xì)胞替代物 | CAR-T | - | 四川大學(xué) | 臨床1期 |
| 羥氯喹/索拉非尼 | BRAF抑制劑 | CRAF抑制劑 | FLT3抑制劑 | PDGFRβ抑制劑 | RET抑制劑 | VEGFR1拮抗劑 | VEGFR2拮抗劑 | VEGFR3拮抗劑 | c-Kit抑制劑 | 小分子化藥 | 卵巢癌 | VG Life Sciences, Inc. | 臨床1期 |
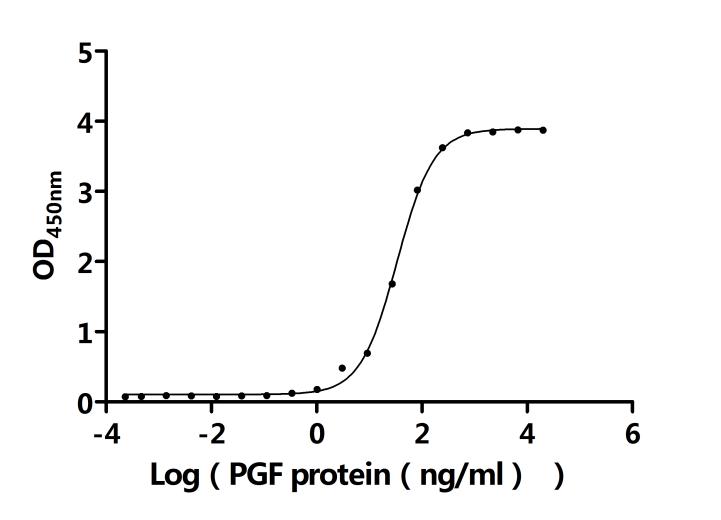
5. 華美生物FLT1研究相關(guān)產(chǎn)品
FLT1作為血管生成和免疫調(diào)控的重要因子,已成為多種疾病的研究焦點。其在CMS、PAH、OA及腫瘤等疾病中的異常表達,提示其不僅是潛在的診斷標(biāo)志物,也是治療干預(yù)的重要靶點。
華美生物已開發(fā)出多種FLT1相關(guān)研究產(chǎn)品,包括重組蛋白、抗體和ELISA世界和,助您進行FLT1相關(guān)機制研究和藥物開發(fā)。
參考文獻:
[1] Yan‐Xia Zhang, Mi‐Rong Jing, Chunbo Cai, Shuai‐Gang Zhu, C. Zhang, Qi‐Meng Wang, Yuankun Zhai, Xin‐Ying Ji, Dongdong Wu. Role of hydrogen sulphide in physiological and pathological angiogenesis[J]. Cell Proliferation, 2022, 56(3).
[2] Fan-Wei Peng, Dake Liu, Qingwen Zhang, Yungen Xu, Lei Shi. VEGFR-2 inhibitors and the therapeutic applications thereof: a patent review (2012-2016)[J]. Expert Opinion on Therapeutic Patents, 2017, 27(9): 987-1004.
[3] Leopold F. Fr?hlich. MicroRNAs at the Interface between Osteogenesis and Angiogenesis as Targets for Bone Regeneration[J]. Cells, 2019, 8(2): 121-121.
[4] Alexander Panossian, Ean‐Jeong Seo, Thomas Efferth. Novel molecular mechanisms for the adaptogenic effects of herbal extracts on isolated brain cells using systems biology[J]. Phytomedicine, 2018, 50: 257-284.
[5] Samanta Taurone, Filippo Galli, Alberto Signore, Enzo Agostinelli, Rudi Dierckx, Antonio Minni, Marcella Pucci, Marco Artico. VEGF in nuclear medicine: Clinical application in cancer and future perspectives (Review)[J]. International Journal of Oncology, 2016, 49(2): 437-447.
[6] Peiyu Liu, Dandan Sun, Shuchang Zhang, Shimei Chen, Xiaoqian Wang, Huiming Li, Wei Fang. PFKFB3 in neovascular eye disease: unraveling mechanisms and exploring therapeutic strategies[J]. Cell & Bioscience, 2024, 14(1).
[7] Maria Giovanna Scioli, Gabriele Storti, Federico D’Amico, Roger Rodríguez Guzmán, Federica Centofanti, Elena Doldo, Ela María Céspedes Miranda, Augusto Orlandi. Oxidative Stress and New Pathogenetic Mechanisms in Endothelial Dysfunction: Potential Diagnostic Biomarkers and Therapeutic Targets[J]. Journal of Clinical Medicine, 2020, 9(6): 1995-1995.
[8] Fengyan Jin, Xiangyu Zheng, Yanping Yang, Gang Yao, Long Ye, Thorsten R. Doeppner, Dirk M. Hermann, Haifeng Wang, Yun Dai. Impairment of hypoxia-induced angiogenesis by LDL involves a HIF-centered signaling network linking inflammatory TNFα and angiogenic VEGF[J]. Aging, 2019, 11(2): 328-349.
[9] Huajuan Jiang, Xulong Huang, Jiaxin Wang, Yongfeng Zhou, Chaoxiang Ren, Tao Zhou, Jin Pei. Hepatoprotective Effect of Medicine Food Homology Flower Saffron against CCl4-Induced Liver Fibrosis in Mice via the Akt/HIF-1α/VEGF Signaling Pathway[J]. Molecules, 2023, 28(21): 7238-7238.
[10] Weiwei Wu, Jiaying Zhao, Yingying Li, Wendi Sun, Xiaohong Ye, Xinyan Chang, Yao He, Qing Jin. Rg1 inhibits the VEGF-Flt1 signaling pathway and microvascular remodeling in knee osteoarthritis rats[J]. Phytotherapy Research, 2022, 36(11): 4991-5002.
[11] Limin Wang, Wenxia Zhang, Bing Zhao, Huijuan Li, Qing Liu, Ping Xu, Jianyong Lei, Zhibin Wang, Xinfeng Yan, Conghui Li. The effect of combined treatment with Salvia miltiorrhiza and Panax notoginseng on vascular regeneration and tissue repair of osteoarthritis[J]. Biomedicine & Pharmacotherapy, 2023, 164: 114869-114869.
[12] Siyuan Chen, Qiang Fu, Yinyan Tang, Ping Wang, Yali Zheng, Ling Ye, Feng Xu. Bispecific antibodies targeting VEGF/Ang-2 for the treatment of liver fibrosis[J]. Immunologic Research, 2023, 71(5): 682-693.
[13] Yuan Xu, Chen Wei, Shuang Liu, Han Sun, Chen Chen, Mengru Li, Zhuohang Li, Wenxing Hu, Xiaobing Wang, Xianmei Meng, Li Li, Hongbo Xin. Single-cell RNA sequencing uncovers heterogeneity and crosstalk of hepatic stellate cells in a CCl4-induced liver fibrosis model[J]. Hepatology Communications, 2024, 8(4): 281-297.
[14] Samantha Lai, Simona Grassi, Vincenzo Nicola Talesa, Francesca Margheri, Lucia Magnelli. Endothelial Dysfunction in Chronic Kidney Disease: Highlighting the Role of FGF23 and Klotho[J]. International Journal of Molecular Sciences, 2024, 25(9): 5689-5689.
[15] Zhen Chen, Yingjie He, Yuchen Wu, Hui Chen, Xiaoyang Hou, Xiang Xiao, Yang Zhang, Jun Zou, Lei Pei, Jing Su, Chunlin Zhang, Xingdong Zhang, Yunsong Liu. Extracellular vesicles from mesenchymal stem cells promote chondrocyte proliferation and migration via miR-135b-5p-mediated modulation of FGF18 in osteoarthritis[J]. Stem Cell Research & Therapy, 2024, 15(1).
[16] Feng Wu, Yanan Zou, Yabin Xu, Chunjie Jiang, Haijun Bao, Ning Xie, Wenlong He. Bone marrow mesenchymal stem cells derived exosomes regulate VEGF/VEGFR2 signaling to promote lung injury repair[J]. Stem Cell Research & Therapy, 2024, 15(1).