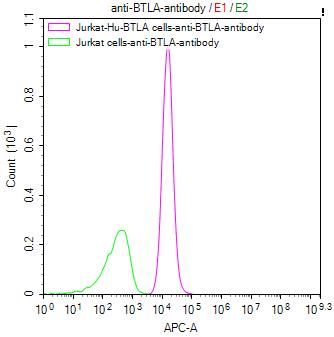
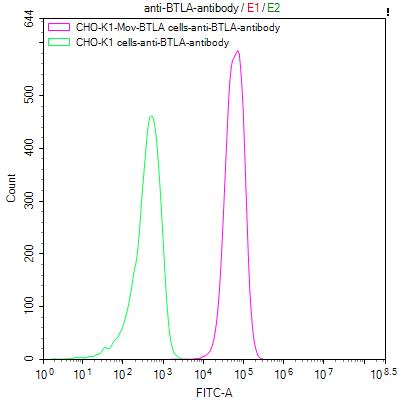
BTLA:免疫治療新興靶點——洞察腫瘤與自身免疫病的新視角
日期:2025-11-18 17:14:08
1. BTLA在免疫調節中的新興作用
免疫檢查點抑制劑(ICIs)的出現標志著腫瘤治療的重大突破,通過激活宿主免疫系統對抗腫瘤,顯著改善了多種癌癥患者的預后 [1]。然而,ICIs面臨響應率不高、免疫相關不良事件(IrAEs)及腫瘤耐藥等挑戰 [2-4],促使科研人員持續探索新的免疫檢查點分子以優化治療策略 [5]。
B和T淋巴細胞衰減器(BTLA,亦稱CD272)是近年來發現的共抑制性受體,屬于免疫球蛋白超家族成員,在維持免疫穩態中發揮關鍵作用,主要介導B細胞和T細胞的免疫衰減 [6,7]。與部分激活后上調的共抑制受體不同,BTLA在靜息T細胞上即組成性表達,且在外周淋巴組織中表達水平較高,提示其可能在T細胞發育早期參與自身耐受的建立 [8]。BTLA廣泛表達于B細胞、CD4+與CD8+ T細胞以及漿細胞樣樹突狀細胞(pDCs),在健康個體中呈現高蛋白表達 [9]。
BTLA的異常表達或功能障礙與多種疾病相關。例如,在慢性淋巴細胞白血病(CLL)患者中,CD4+與CD8+ T細胞表面BTLA表達顯著升高,且高水平BTLA與較短治療起始時間相關,提示其促進T細胞耗竭并限制抗腫瘤免疫應答 [10]。此外,BTLA基因的功能性單核苷酸多態性(SNP),如590C位點,與類風濕關節炎(RA)易感性顯著相關,攜帶該等位基因的患者發病更早,且該突變型BTLA在Jurkat T細胞中喪失對IL-2產生的抑制能力,進一步證實其在自身免疫保護中的作用 [11]。在系統性紅斑狼瘡(SLE)中,HVEM蛋白水平下降而BTLA相對穩定,提示BTLA激動劑可能為低HVEM表達的SLE患者提供治療新思路 [9]。
鑒于BTLA在免疫調控及疾病進展中的核心地位,深入研究其機制與臨床應用具有重要價值。本文旨在全面梳理BTLA的分子背景、作用機制、信號通路、相關疾病及藥物研發進展,展望其在免疫治療領域的潛力。
2. BTLA的分子結構、表達調控與配體互作
2.1 BTLA分子結構與胞內信號基序
BTLA屬于B7-CD28家族抑制性免疫檢查點受體,其抑制功能主要依賴胞內段所含免疫受體酪氨酸抑制基序(ITIM)和免疫受體酪氨酸轉換基序(ITSM)。這些基序在酪氨酸磷酸化后,可特異性招募含SH2結構域的磷酸酶SHP1和SHP2,進而啟動負向信號轉導[13,14]。
BTLA的ITIM基序在招募SHP1時起主導作用,尤其通過其N端SH2結構域(nSH2)實現高親和力結合[13]。與PD-1主要經ITSM基序結合SHP2的C端SH2結構域(cSH2)不同,BTLA的ITIM中磷酸化酪氨酸后第一位氨基酸的分子體積對SHP1招募具有“鐘形”依賴性,結構差異決定其效應蛋白選擇性[13]。突變BTLA胞內酪氨酸基序可減少SHP-1/2招募,同時保留Grb2結合能力,從而增強NFAT信號通路,提升T細胞體內持久性與抗腫瘤功能[12]。這些發現揭示BTLA胞內基序結構對其抑制功能及治療開發具有決定性意義。
2.2 BTLA在免疫細胞中的表達與調控
BTLA在健康個體中高表達于B細胞、CD4+與CD8+ T細胞及漿細胞樣樹突狀細胞(pDC)[9],提示其在免疫穩態中的廣泛作用。在疾病狀態下,BTLA表達模式發生改變。例如,在非小細胞肺癌(NSCLC)中,腫瘤細胞BTLA高表達與淋巴結侵犯、晚期分期及不良無復發生存期(RFS)相關 [15]。肺腺癌中也觀察到BTLA顯著過表達 [5]。
T細胞發育過程中,BTLA在胸腺中表達較低,而在外周T細胞中顯著升高,與CD5表達呈負相關 [8]。BTLA通過自身信號(非HVEM配體)調控CD4 T細胞中CD5水平,對新生成T細胞建立自身耐受至關重要。BTLA缺陷的胸腺遷出細胞(RTE)會引發多器官自身免疫疾病,突顯其在外周耐受中的作用 [8]。
表觀遺傳調控亦影響BTLA表達。啟動子區CpG位點(如cg24157392、cg03995631)低甲基化與BTLA mRNA和蛋白表達上調相關,預示黑色素瘤患者更長總生存期(OS)及更高免疫細胞浸潤水平,可作為免疫治療響應與預后的生物標志物 [16]。此外,T細胞譜系蛋白THEMIS作為BTLA信號“調節器”,賦予T細胞抵抗BTLA介導的抑制,促進T細胞發育與維持 [17],顯示細胞內因子對免疫檢查點功能的精細調控。
2.3 BTLA主要配體HVEM及其雙向信號
BTLA的主要生理配體為皰疹病毒侵入介質(HVEM,亦稱TNFRSF14),屬于腫瘤壞死因子受體(TNFR)家族 [18-20]。BTLA與HVEM結合構成關鍵抑制性免疫檢查點,調控T細胞與B細胞免疫應答,其阻斷被視為腫瘤治療新策略 [21]。
HVEM作為多功能受體,還可與LIGHT(TNFSF14)及CD160等配體結合,形成共刺激或共抑制信號網絡 [22,20,23]。在類風濕關節炎(RA)患者中,T淋巴細胞上HVEM與LIGHT表達下降,BTLA上升,提示該通路參與RA發病 [24]。CD160基因多態性亦與自身免疫性甲狀腺疾病(AITD)如格雷夫斯病易感性相關,凸顯CD160/HVEM/LIGHT/BTLA通路在自身免疫中的關鍵地位 [25]。
BTLA-HVEM軸可介導雙向信號:BTLA向T細胞傳遞抑制信號,HVEM則向表達其的細胞傳遞信號 [18,22]。兩者可在同一細胞表面以順式(cis)結合,阻斷其他配體與HVEM的反式(trans)結合,降低共刺激活性,但BTLA抑制作用仍得以保留[22]。反式結合則是不同細胞間BTLA與HVEM的相互作用,為主要抑制途徑 [21]。針對HVEM-BTLA順式復合物的定量檢測方法已建立,為深入研究其功能調控提供工具 [18]。
在肝膽損傷模型中,HVEM或BTLA缺陷小鼠在DDC誘導后出現更重損傷與修復障礙,伴隨腸道菌群與IgA反應失調,提示該信號軸通過調控腸道微生態限制肝損傷 [26]。在抗病毒免疫中,HVEM-BTLA雙向共刺激系統驅動記憶CD8 T細胞分化,缺陷會削弱效應CD8 T細胞存活與免疫記憶形成 [23]。
腫瘤微環境中,黑色素瘤相關成纖維細胞(MAFs)通過上調HVEM等抑制性受體抑制CTL活性 [27]。靶向HVEM的單抗在體外與體內均顯示抗腫瘤效果,增強T細胞活化并降低耗竭 [19,20,28]。在CAR-T療法中,敲除BTLA可減少SHP-1/2募集,增強CAR-T細胞抗腫瘤功能 [12],突顯BTLA-HVEM軸作為治療靶點的重要價值。
2.4 其他潛在配體與進化保守性
BTLA配體結合特性在進化上呈現多樣性。在斑馬魚中,研究發現存在PD-L1/BTLA共抑制軸,可能作為哺乳動物PD-L1/PD-1軸的進化替代 [29]。在愛德華氏菌感染中,斑馬魚PD-L1(DrPD-L1)與BTLA(DrBTLA)在MHC II+巨噬細胞與CD8+ T細胞上上調,兩者間具有高親和力(KD = 5.68 nM)。阻斷該相互作用可增強CD8+BTLA+ T細胞對感染巨噬細胞的殺傷,降低病原體免疫逃逸 [29]。該原始檢查點軸在硬骨魚類中調控CD8+ T細胞活化,顯示BTLA在免疫調控中的古老進化根源。
盡管PD-1近年來被認為僅存在于四足動物,但數據庫分析顯示其在硬骨魚與軟骨魚中亦存在 [30]。PD-1及其配體在進化中保守的細胞外與細胞內結合模式及糖基化位點,支持其古老起源,提示免疫檢查點機制在物種間的保守性與適應性。
3. BTLA信號轉導與免疫抑制機制
3.1 ITIM/ITSM磷酸化與SHP1/SHP2招募
BTLA在T細胞活化后,其胞內ITIM與ITSM基序發生酪氨酸磷酸化,進而招募SHP1與SHP2磷酸酶,抑制T細胞早期活化與功能 [12,14,31]。與PD-1偏好經ITSM招募SHP2不同,BTLA主要通過ITIM基序優先招募SHP1 [13]。結構研究表明,ITIM中磷酸化酪氨酸后第一位殘基的分子體積對SHP1招募具鐘形依賴性,BTLA該位點為丙氨酸,利于與SHP1的nSH2結構域穩定結合 [13]。PD-1則因該位點為甘氨酸,其ITIM在SHP1招募中作用較弱;替換為丙氨酸后可增強與SHP1互作 [13]。PD-1對SHP2的招募需ITIM與ITSM共同參與,分別結合SHP2的nSH2與cSH2,誘導構象變化激活SHP2磷酸酶活性 [32,33]。盡管SHP1與SHP2在抑制初始T細胞向效應與記憶表型分化中存在功能冗余,但SHP1通常占主導 [34]。BTLA與PD-1在SHP酶招募上的差異,體現免疫檢查點受體對下游信號通路的精準調控。
3.2 對T細胞活化、增殖與分化的影響
BTLA通過招募SHP1與SHP2,對T細胞受體(TCR)信號通路關鍵分子如CD3ζ、ZAP70與Lck進行去磷酸化,阻斷TCR早期信號,抑制T細胞活化、增殖及細胞因子產生 [17]。在哮喘模型中,BTLA激動劑通過SHP-1依賴性方式抑制NF-κB信號,減少Th17細胞數量與IL-17水平,緩解氣道高反應性與肺部炎癥 [35]。CLL患者T細胞中BTLA高表達導致IL-2與IFN-γ產生下降,限制抗腫瘤應答 [10]。BTLA基因多態性(如590C SNP)可削弱其對Jurkat T細胞IL-2產生的抑制,參與自身免疫病發生 [11]。
在T細胞分化方面,SHP1與SHP2共同抑制初始T細胞向效應與中央記憶表型分化 [34]。BTLA在T細胞發育早期通過信號傳導調控CD5表達,CD5水平升高與自身肽-MHC識別增強相關,表明BTLA參與建立新生成T細胞的自身耐受 [8]。BTLA缺陷RTE引發多器官自身免疫,依賴CD4 T細胞與MHC II類分子 [8]。在抗病毒免疫中,CD8α+樹突狀細胞表達的BTLA可作為反式激活配體,經T細胞上HVEM傳遞共刺激信號,驅動記憶CD8 T細胞分化與存活 [23],顯示BTLA-HVEM軸在免疫記憶中的關鍵作用。
3.3 對B細胞、NK細胞與巨噬細胞功能的影響
BTLA亦表達于B細胞、NK細胞與巨噬細胞,參與調控其功能。在結直腸癌(CRC)中,BTLA表達與幼稚B細胞、記憶B細胞等浸潤水平相關,提示其在B細胞介導免疫中的潛在作用 [36]。盡管直接證據尚少,推測BTLA可能通過類似T細胞的機制抑制B細胞活化、增殖與抗體分泌。CLL中BTLA失調主要影響T細胞,其對B細胞本身的作用仍需深入探索 [10]。
在腎小球腎炎模型中,BTLA通過抑制致病性T細胞并促進調節性T細胞(Treg)擴增,發揮腎臟保護作用 [37]。在CRC中,BTLA表達與靜息NK細胞浸潤相關,并參與NK細胞介導的細胞毒性通路 [36]。單核細胞、M0與M1型巨噬細胞浸潤亦與BTLA表達相關,提示BTLA可能通過調控巨噬細胞極化與功能影響腫瘤微環境 [36]。BTLA如何直接調節這些細胞的具體機制,仍是未來研究重點。
3.4 BTLA與其他免疫檢查點的交叉調控
BTLA與PD-1、CTLA-4、TIGIT、LAG-3、TIM-3等免疫檢查點共同構成復雜調控網絡。在Sézary綜合征中,腫瘤T細胞上BTLA、FCRL3與TIGIT表達上調,而LAG-3+細胞減少,顯示不同受體在疾病中表達模式的異質性 [38]。NSCLC中BTLA與LAG-3、TIGIT、CTLA-4、PD-1等均上調,但腫瘤亞群呈現不同免疫檢查點基因表達譜,提示免疫逃逸機制的異質性 [5]。膽道癌(BTC)患者中,CD8+BTLA+ T細胞高頻率與更好總生存期相關,而CD4+TIM3+與CD8+VISTA+ T細胞變化與不同臨床結局相關,凸顯各檢查點在預后中的獨特作用 [39]。
聯合靶向多個檢查點可產生協同效應。在小鼠胰島移植模型中,CTLA4Ig與抗BTLA單抗聯用可實現移植物長期存活,誘導供體特異性耐受 [40]。工程化樹突狀細胞(DCs)共表達CTLA-4、PD-1與BTLA配體,可有效抑制CD4+ T細胞增殖與促炎細胞因子,增加Treg頻率,抑制自身免疫性甲狀腺炎 [41]。腫瘤微環境中,MAFs通過精氨酸酶活性上調TIGIT與BTLA,抑制CTL功能 [27];CD47阻斷可減少耗竭性BTLA+ CD4+ T細胞,促進NK與CD8+ T細胞擴增 [42]。在信號層面,T細胞特異性缺失SHP1與SHP2雖可抑制初始T細胞分化,但同時缺失會導致腫瘤控制不佳且對PD-1阻斷無響應,揭示SHP1/SHP2在維持T細胞存活與腫瘤免疫中的關鍵作用 [34]。這些研究共同表明,BTLA與其他免疫檢查點存在復雜交叉調控,深入理解其相互作用對開發聯合免疫療法至關重要。
3.5 BTLA表達的精細調控機制
BTLA表達受表觀遺傳、細胞內因子及微RNA等多層次調控。啟動子區特定CpG位點低甲基化與BTLA mRNA和蛋白高表達相關,預示黑色素瘤患者更好預后與更高免疫細胞浸潤 [16]。CD5與BTLA在胸腺與外周呈負相關表達,BTLA通過自身信號調控CD5水平,參與自身耐受建立 [8]。THEMIS作為BTLA信號“變阻器”,限制其抑制作用,促進T細胞發育與維持 [17]。在CLL中,miR-155-5p上調可部分降低B細胞BTLA蛋白水平,但在T細胞中沉默miR-155-5p未顯著改變BTLA表達,提示其調控具有細胞類型特異性,為靶向miR-155-5p的免疫治療提供依據 [43]。
4. BTLA在疾病中的作用與生物標志物潛力
4.1 BTLA在腫瘤免疫逃逸中的作用
BTLA在多種腫瘤中高表達,與患者預后不良及免疫逃逸相關。泛癌分析顯示,約19%腫瘤存在BTLA RNA高表達,且與PD-1、CTLA-4、HVEM、CD160等檢查點獨立相關 [44]。在骨肉瘤中,可溶性BTLA(sBTLA)與肺轉移及疾病進展風險顯著相關,具生物標志物潛力 [45]。
在非小細胞肺癌(NSCLC)中,腫瘤細胞BTLA高表達與淋巴侵犯、晚期分期及較差無復發生存期(RFS)和總生存期(OS)相關 [15]。口腔鱗癌(OSCC)中BTLA表達上調,與PD-1、PD-L1、PD-L2、CD96等正相關,構成局部免疫檢查點網絡 [47]。前列腺癌中HVEM與BTLA mRNA高表達預示較差無進展生存期 [19]。CLL患者T細胞BTLA表達升高,CD4+ T細胞高BTLA與較短治療起始時間相關[10]。蕈樣肉芽腫(MF)進展期,耗竭性BTLA+ CD4+ T細胞在腫瘤周圍密度增加,形成抑制性微環境 [42]。Sézary綜合征(SS)腫瘤T細胞中BTLA、FCRL3、TIGIT表達上調[38]。膽道癌(BTC)中CD8+BTLA+ T細胞高頻率與更好總生存期相關,顯示BTLA在不同腫瘤背景下的作用復雜性 [39]。
結直腸癌(CRC)中BTLA在腫瘤組織表達低于正常組織,低BTLA與較差總生存期相關,被列為有利預后因素 [36]。黑色素瘤中BTLA啟動子低甲基化導致高表達,預示更長總生存期及更好免疫治療響應 [16],與通常認為BTLA為抑制分子的觀點形成對比,提示其功能具有腫瘤類型特異性。
4.2 BTLA在自身免疫病與炎癥反應中的作用
BTLA在維持自身免疫耐受中起關鍵作用,其基因多態性、異常表達或功能缺陷與多種自身免疫病相關。
類風濕關節炎(RA)中,BTLA基因590C SNP與疾病易感性及早發相關,該突變型BTLA在體外喪失對IL-2產生的抑制能力 [11]。AI分析顯示BTLA與PADI4、FCGR3、TNFRSF1B、ITGAV等RA候選基因存在互作網絡 [50]。盡管RA患者循環T細胞BTLA表達比例升高,但HVEM與LIGHT表達下降 [24],提示BTLA-HVEM-LIGHT通路失衡可能導致有效免疫抑制不足,參與疾病進展。
系統性紅斑狼瘡(SLE)患者BTLA蛋白水平與健康人相當,但HVEM蛋白顯著降低,且HVEM基因表達與疾病活動度負相關 [9],為BTLA激動劑治療低HVEM表達SLE提供依據。
干燥綜合征(SjS)患者外周血淋巴細胞BTLA、HVEM、CD160表達及共表達頻率降低,T細胞上BTLA/HVEM與CD160/HVEM共表達減少,表明該軸在SjS中失調,可能成為治療靶點 [51]。早期研究未發現BTLA 590C SNP與SLE或SjS易感性相關 [11],提示BTLA基因多態性在不同自身免疫病中作用模式不同。
強直性脊柱炎(AS)與中國漢族人群BTLA基因rs2171513多態性相關 [54]。自身免疫性甲狀腺疾病(AITD)如格雷夫斯病與CD160基因rs744877多態性相關,凸顯CD160/HVEM/LIGHT/BTLA通路在自身免疫中的作用 [25]。
在動脈粥樣硬化中,BTLA激動劑抗體(3C10)治療可減輕病變,減少濾泡B2細胞,增加調節性B細胞與T細胞,增強斑塊膠原含量,提示其穩定斑塊作用 [55]。實驗性腎小球腎炎中,BTLA缺陷加重腎炎,而BTLA激動劑抗體通過抑制致病性Th1細胞、促進Treg擴增減輕腎臟炎癥,保護腎功能 [56,37]。這些發現表明BTLA信號在限制腎臟炎癥中具重要意義,抗體調節BTLA可能成為人類腎小球腎炎的治療策略。
4.3 BTLA在感染與其他病理過程中的作用
在HTLV-1感染中,病毒蛋白HBZ抑制感染細胞與ATL細胞BTLA與LAIR-1表達,增強TIGIT與PD-1表達但削弱其抑制功能 [52]。HBZ通過與THEMIS互作阻礙SHP-2與PD-1共定位,削弱PD-1與TIGIT信號,促進T細胞增殖 [52]。HAM/TSP患者血清及HTLV-1來源細胞外囊泡(EVs)與外泌體中sBTLA、LAG-3、PD-L2等可溶性免疫檢查點分子升高 [49],這些外泌體攜帶BTLA可損害健康CD8 T細胞功能 [49]。HBZ敲低減少EVs釋放與免疫檢查點分子分泌,提示其在HTLV-1神經炎癥中通過外泌體介導免疫調節 [49]。
在哮喘模型中,BXD75小鼠表現中性粒細胞偏斜、類固醇抵抗及Th17細胞升高,肺部CD4+ T細胞HVEM表達增加、BTLA降低,NF-κB信號增強 [35]。BTLA激動劑可減輕氣道高反應性與肺部炎癥,體外通過SHP-1介導抑制NF-κB,減少Th17細胞與IL-17 [35],提示BTLA激動劑可用于類固醇抵抗性哮喘。
斑馬魚中存在的PD-L1/BTLA檢查點軸在愛德華氏菌感染中調控CD8+ T細胞活化,阻斷該軸可增強CD8+BTLA+ T細胞對感染巨噬細胞的殺傷,降低病原體逃逸 [29],表明BTLA在進化早期已參與抗感染免疫。
危重癥患者免疫抑制狀態與HVEM/BTLA共表達增加相關,小鼠模型及患者循環淋巴細胞中CD3+淋巴細胞HVEM+BTLA+共表達升高,與TNF-α水平正相關,提示其參與免疫抑制發生 [48]。HVEM表達可增強異體骨髓間充質干細胞(allo-MSCs)免疫抑制與骨生成能力,促進股骨缺損模型中新骨形成 [31]。HVEM-BTLA信號在DDC誘導肝損傷中通過調節腸道菌群與IgA反應限制肝損傷 [26]。這些研究揭示BTLA在感染、炎癥及多種生理病理過程中的廣泛調節功能。
4.4 可溶性BTLA(sBTLA)作為疾病生物標志物
可溶性BTLA(sBTLA)作為循環生物標志物,在腫瘤等疾病診斷與預后評估中展現潛力。基底細胞癌(BCC)患者血漿sBTLA水平低于健康對照,而sCTLA-4、sLAG-3、sPD-1、sPD-L1、sTIM-3等升高 [4],提示sBTLA在BCC免疫微環境中作用獨特。
骨肉瘤(OS)中,sBTLA與sPDL2、sCD27共同與肺轉移風險相關,sBTLA與sTIM3與疾病進展風險相關 [45]。基于sBTLA、sPD-1、sTIM-3、sPDL2的免疫亞型可區分無進展生存期(PFS)與無肺轉移生存期(LMFS)不同患者,提示sBTLA在OS預后與免疫治療指導中的價值。
NSCLC患者化療組與PD-1阻斷治療組血漿中sBTLA與其他可溶性免疫檢查點分子(如sCD27、sCD28、sPD-1、sPD-L1)升高 [46],反映腫瘤負荷或治療誘導免疫反應。sBTLA作為多標志物面板一部分,在評估NSCLC侵襲風險中具潛力 [3]。細胞表面BTLA在NSCLC中與淋巴浸潤、晚期分期、PD-L1高表達及不良預后相關 [15],提示可溶性與膜結合形式BTLA可能發揮互補預后作用。
膽道癌(BTC)中CD8+BTLA+ T細胞高頻率與更好總生存期相關 [39],間接支持sBTLA在該病中的研究價值。前列腺腺癌中HVEM與BTLA mRNA高表達與較差無進展生存期相關 [19],印證該軸在腫瘤進展中的作用。
sBTLA在不同腫瘤中水平變化與預后關聯呈現異質性,可作為單一或組合生物標志物,為癌癥早期診斷、進展監測、治療反應評估及個體化免疫治療提供液體活檢信息。其具體機制、最佳檢測時機及與膜結合型BTLA互作復雜性仍需深入研究。
5. BTLA靶向藥物研究進展
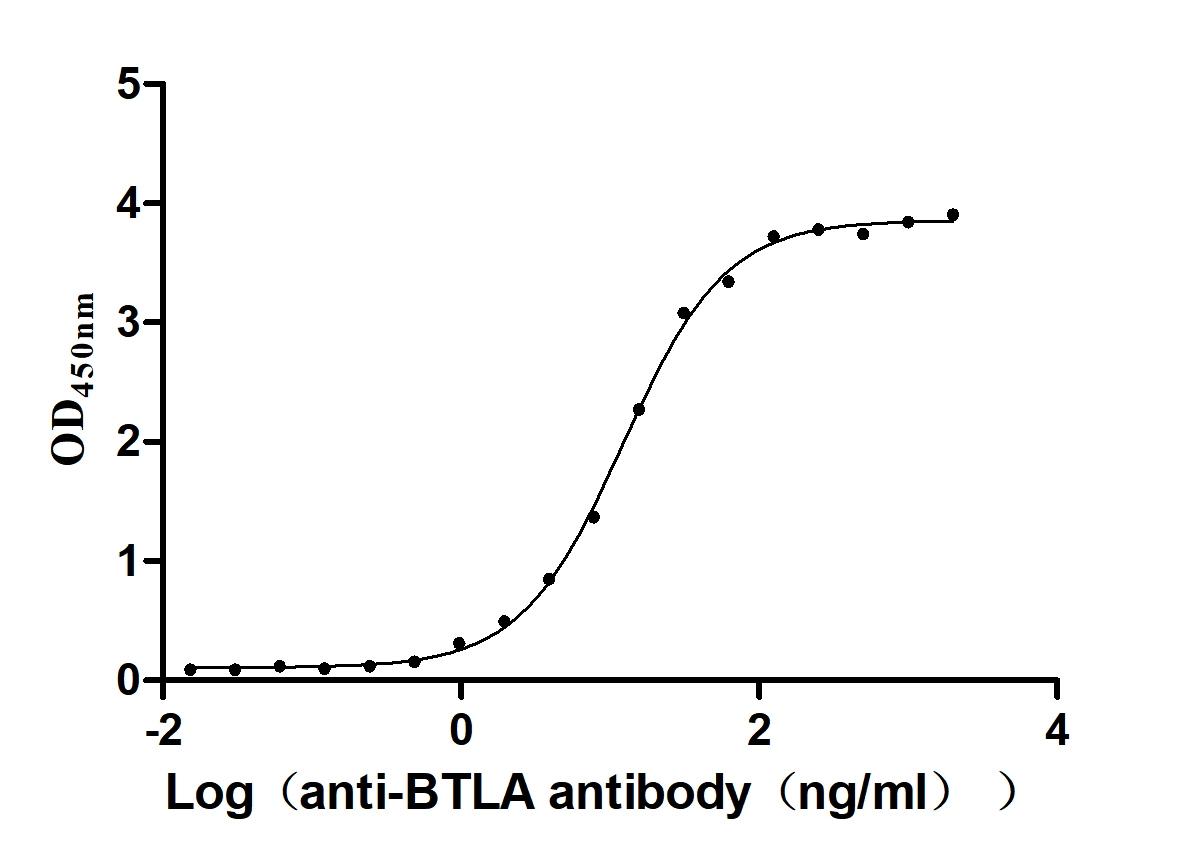
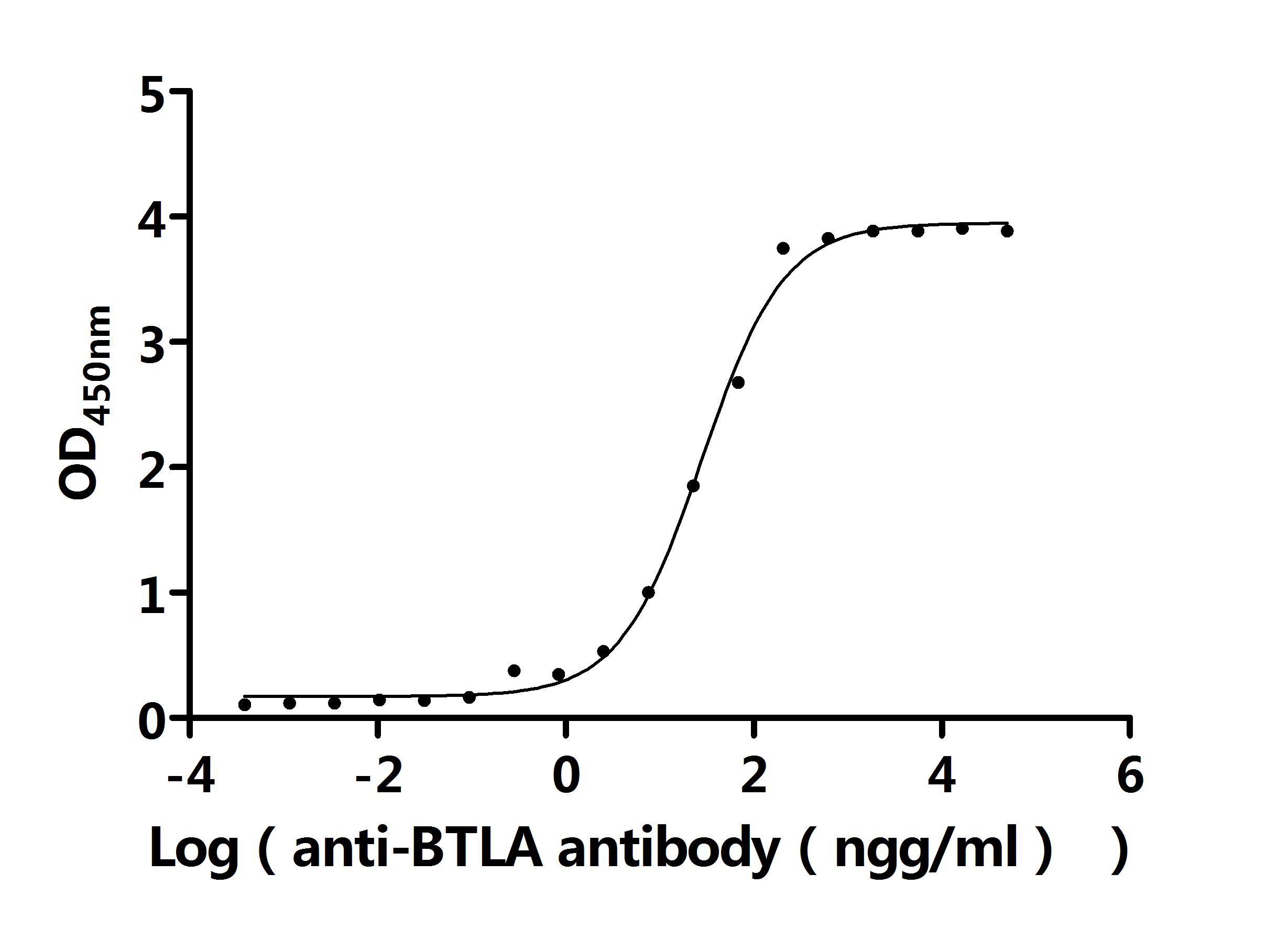
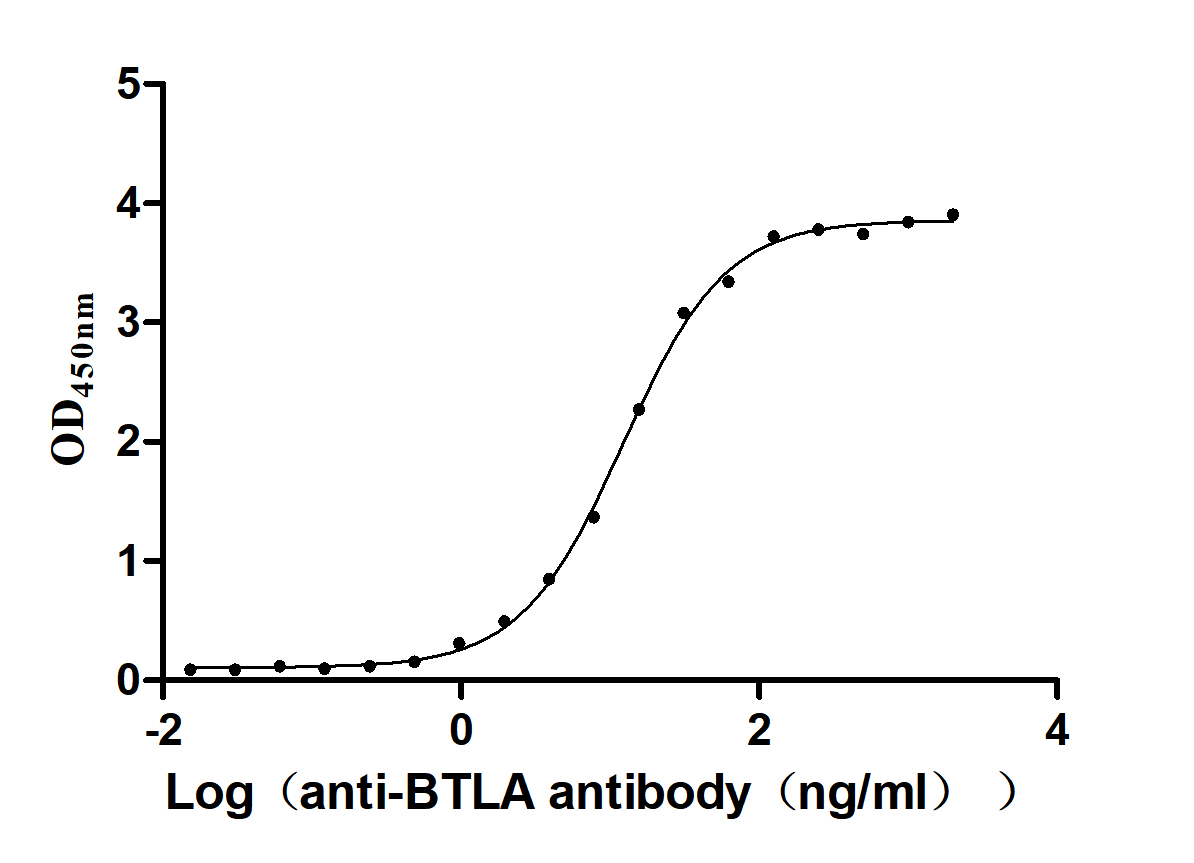
作為近年來腫瘤免疫治療領域一個備受關注的新興靶點,BTLA靶向藥物,特別是與其配體HVEM結合的抑制劑,已在多種腫瘤的臨床研究中展現出潛力,并且在自身免疫性疾病和移植排斥反應等領域也顯示出應用前景。目前BTLA靶向藥物的研發高度集中于惡性腫瘤領域,并已進入中后期臨床研究階段。部分在研管線列舉如下表:
| 藥物 | 作用機制 | 藥物類型 | 在研適應癥(疾病名) | 在研機構 | 最高研發階段 |
|---|---|---|---|---|---|
| 重組人源化抗BTLA單克隆抗體(Shanghai Junshi Biosciences) | BTLA阻滯劑 | 單克隆抗體 | 典型霍奇金淋巴瘤 | 難治性經典霍奇金淋巴瘤 | 廣泛期小細胞肺癌 | 局限期小細胞肺癌等 | 上海君實生物醫藥科技股份有限公司 | 上海市肺科醫院 | 臨床3期 |
| GS-0272 | BTLA阻滯劑 | 小分子化藥 | 類風濕關節炎 | Gilead Sciences, Inc. | 臨床1期 |
| 注射用聚乙二醇化重組人血管內皮抑制素 (先聲藥業) | BTLA刺激劑 | 重組蛋白 | 轉移性非小細胞肺癌 | 山東先聲生物制藥有限公司 | 中國藥科大學 | 江蘇先聲藥業有限公司 | 臨床1期 |
| ANB-032 | BTLA刺激劑 | 單克隆抗體 | 特應性皮炎 | AnaptysBio, Inc. | 臨床1期 |
| HFB-200603 | BTLA阻滯劑 | 單克隆抗體 | 晚期惡性實體瘤 | 結直腸癌 | 黑色素瘤 | 非小細胞肺癌等 | 高誠生物醫藥(杭州)有限公司 | Hifibio SAS | 臨床1期 |
| MB-272 | BTLA阻滯劑 | 單克隆抗體 | 自身免疫性疾病 | MiroBio Ltd. | 臨床1期 |
| HFB-200604 | BTLA刺激劑 | 單克隆抗體 | 自身免疫性疾病 | 高誠生物醫藥(杭州)有限公司 | 臨床申請批準 |
| MG-B-28 | BTLA阻滯劑 | 小分子化藥 | 腫瘤 | Weill Cornell Medicine | Mansoura University | 臨床前 |
(數據截止到2025年11月13日,來源于synapse)
6. BTLA研究工具
BTLA作為關鍵共抑制受體,在維持T細胞自身耐受、調節免疫應答及抑制T細胞功能中發揮核心作用,在自身免疫病與腫瘤免疫中具雙重調節潛力 [8,74,10]。sBTLA作為新興生物標志物,在腫瘤預后與治療指導中價值初顯。靶向BTLA/HVEM軸的激動劑與拮抗劑研發為自身免疫病與腫瘤治療提供新方向。
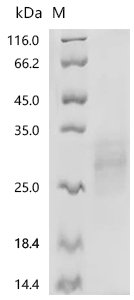
華美生物提供BTLA重組蛋白、抗體及ELISA試劑盒產品,助力您進行相關機制研究及靶向藥物開發。
參考文獻:
[1] Michael Shapiro, Herut Dor, Anna Gurevich-Shapiro, Tal Etan, Ido Wolf.(2024). Institutional-Level Monitoring of Immune Checkpoint Inhibitor IrAEs Using a Novel Natural Language Processing Algorithmic Pipeline.
[2] Kamran Kaveh, Feng Fu.(2021). Immune checkpoint therapy modeling of PD-1/PD-L1 blockades reveals subtle difference in their response dynamics and potential synergy in combination.
[3] Qinchuan Wang, Yue He, Wanlu Li, Xiaohang Xu, Qingfeng Hu, Zilong Bian, A. Xu, H. Tu, Ming Wu, Xifeng Wu.(2022). Soluble Immune Checkpoint-Related Proteins in Blood Are Associated With Invasion and Progression in Non-Small Cell Lung Cancer.
[4] B. Rapoport, R. Anderson, N. Malinga, H. Steel, P. Meyer, T. Smit, M. Kgokolo.(2023). Transforming growth factor-b1 and soluble co-inhibitory immune checkpoints as putative drivers of immune suppression in advanced basal cell carcinoma.
[5] A. Desai, V. Subbiah, A. Dimou, J. Deshane, Kayla F. Goliwas, S. Ponnazhagan, D. Das, M. Khalil, Y. Lo, Edwin Lin.(2023). Exploring the potential of combination immune checkpoint strategies in non-small cell lung cancer (NSCLC).
[6] Chun Zeng, Tinghe Wu, Y. Zhen, X. Xia, Yong Zhao.(2005). BTLA, a new inhibitory B7 family receptor with a TNFR family ligand.
[7] W. Hobo, W. J. Norde, N. Schaap, H. Fredrix, F. Maas, Karen Schellens, J. Falkenburg, A. Korman, D. Olive, R. van der Voort, H. Dolstra.(2012). B and T Lymphocyte Attenuator Mediates Inhibition of Tumor-Reactive CD8+ T Cells in Patients After Allogeneic Stem Cell Transplantation.
[8] Adeolu O. Adegoke, G. Thangavelu, Ting-Fang Chou, Marcos I. Petersen, K. Kakugawa, J. May, K. Joannou, Qingyang Wang, K. K. Ellestad, Louis Boon, Peter A. Bretscher, H. Cheroutre, Mitchell Kronenberg, T. Baldwin, Colin C. Anderson.(2024). Internal regulation between constitutively expressed T cell co-inhibitory receptors BTLA and CD5 and tolerance in recent thymic emigrants.
[9] Andrew C Vendel, L. Jaroszewski, Matthew D Linnik, Adam Godzik.(2024). B‐ and T‐Lymphocyte Attenuator in Systemic Lupus Erythematosus Disease Pathogenesis.
[10] Christian Sordo-Bahamonde, Seila Lorenzo-Herrero, Alejandra G Martinez-Perez, A. P. Gonzalez-Rodriguez, á. Payer, E. González-García, Candelaria Aguilar-García, Sara González-Rodríguez, A. López-Soto, A. García-Torre, S. González.(2023). BTLA dysregulation correlates with poor outcome and diminished T cell-mediated antitumor responses in chronic lymphocytic leukemia.
[11] Mie Oki, N. Watanabe, T. Owada, Yoshihiro Oya, K. Ikeda, Y. Saito, R. Matsumura, Y. Seto, I. Iwamoto, H. Nakajima.(2011). A Functional Polymorphism in B and T Lymphocyte Attenuator Is Associated with Susceptibility to Rheumatoid Arthritis.
[12] P. Guruprasad, A. Carturan, Yunlin Zhang, K. G. Kumashie, Ivan J Cohen, G. Ghilardi, Ki-Hyun Kim, Jong-Seo Lee, Yoon Lee, Jong-Hoon Kim, J. Chung, Maksim Shestov, R. Pajarillo, Jaryse Harris, Yong Gu Lee, Michael Wang, H. Ballard, Aasha Gupta, O. Ugwuanyi, S. Hong, Linhui Chen, L. Paruzzo, Shane C Kammerman, R. Patel, O. Shestova, L. Vella, S. Schuster, J. Svoboda, P. Porazzi, M. Ruella.(2023). Modulation of the Btla-HVEM Axis to Enhance CAR T Cell Immunotherapy Against Cancer.
[13] Xiaozheng Xu, T. Masubuchi, Qixu Cai, Yunlong Zhao, E. Hui.(2021). Molecular features underlying differential SHP1/SHP2 binding of immune checkpoint receptors.
[14] J. Chemnitz, R. Parry, K. Nichols, C. June, J. Riley.(2004). SHP-1 and SHP-2 Associate with Immunoreceptor Tyrosine-Based Switch Motif of Programmed Death 1 upon Primary Human T Cell Stimulation, but Only Receptor Ligation Prevents T Cell Activation1.
[15] Xiangmin Li, Zhaoguo Xu, Guoyuan Cui, Li Yu, Xiaoye Zhang.(2020). BTLA Expression in Stage I–III Non–Small-Cell Lung Cancer and Its Correlation with PD-1/PD-L1 and Clinical Outcomes.
[16] Minglei Yang, Chenxi Zheng, Yu Miao, Cuicui Yin, Longfei Tang, Chongli Zhang, Pu Yu, Qingfang Han, Yihui Ma, Shenglei Li, Guozhong Jiang, Wencai Li, Peiyi Xia.(2025). BTLA promoter hypomethylation correlates with enhanced immune cell infiltration, favorable prognosis, and immunotherapy response in melanoma.
[17] Suzanne Mélique, Aurélie Vadel, Nelly Rouquié, Cui Yang, Cyrielle Bories, Coline Cotineau, Abdel Saoudi, N. Fazilleau, Renaud Lesourne.(2024). THEMIS promotes T cell development and maintenance by rising the signaling threshold of the inhibitory receptor BTLA.
[18] Shane Atwell, T. Cheung, Elaine M Conner, Carolyn Ho, Jiawen Huang, Erin L Harryman, Ricky Lieu, Stacie Lim, Wai W Lin, Diana I Ruiz, Andrew C Vendel, Carl F Ware.(2025). Quantitative detection of the HVEM-BTLA checkpoint receptor cis-complex in human lymphocytes.
[19] N. Aubert, S. Brunel, D. Olive, G. Marodon.(2021). Blockade of HVEM for Prostate Cancer Immunotherapy in Humanized Mice.
[20] C. Demerlé, L. Gorvel, M. Mello, S. Pastor, C. Degos, A. Zarubica, F. Angelis, F. Fiore, J. Nunès, B. Malissen, L. Greillier, G. Guittard, H. Luche, F. Barlesi, D. Olive.(2023). Anti-HVEM mAb therapy improves antitumoral immunity both in vitro and in vivo, in a novel transgenic mouse model expressing human HVEM and BTLA molecules challenged with HVEM expressing tumors.
[21] Karolina Wojciechowicz, Katarzyna Kuncewicz, Jacek Rutkowski, Jacek Jassem, Anna Wardowska, M. Spodzieja.(2024). The effect of gD-derived peptides on T cell immune response mediated by BTLA-HVEM protein complex in melanoma patients.
[22] C. Battin, J. Leitner, Petra Waidhofer-S?llner, K. Grabmeier-Pfistershammer, D. Olive, P. Steinberger.(2022). BTLA inhibition has a dominant role in the cis-complex of BTLA and HVEM.
[23] R. Flynn, Tarun E. Hutchinson, K. Murphy, C. Ware, M. Croft, Shahram Salek-Ardakani.(2013). CD8 T Cell Memory to a Viral Pathogen Requires Trans Cosignaling between HVEM and BTLA.
[24] Bin Yang, Zhuochun Huang, Wei-hua Feng, Wei Wei, Junlong Zhang, Y. Liao, Linhui Li, Xinle Liu, Zhiqiang Wu, B. Cai, Yang-juan Bai, Lanlan Wang.(2016). The Expression of LIGHT Was Increased and the Expression of HVEM and BTLA Were Decreased in the T Cells of Patients with Rheumatoid Arthritis.
[25] Weiwei He, Jing Zhao, Xue-rong Liu, Sheli Li, K. Mu, Jing Zhang, Jin-an Zhang.(2020). Associations between CD160 polymorphisms and autoimmune thyroid disease: a case-control study.
[26] Yanbo Kou, Xingping Zheng, Liyuan Meng, Mengnan Liu, Shihong Xu, Qiyue Jing, Shenghan Zhang, Hanying Wang, Jinzhi Han, Zhuanzhuan Liu, Yanxia Wei, Yugang Wang.(2022). The HVEM-BTLA Immune Checkpoint Restrains Murine Chronic Cholestatic Liver Injury by Regulating the Gut Microbiota.
[27] B. érsek, P. Silló, U?ur ?ak?r, V. Molnar, A. Bencsik, Balázs Mayer, é. Mezey, S. Kárpáti, Z. Pós, K. Nemeth.(2020). Melanoma-associated fibroblasts impair CD8+ T cell function and modify expression of immune checkpoint regulators via increased arginase activity.
[28] L. Gorvel, C. Demerlé, M. Mello, S. Pastor, C. Degos, A. Zarubica, F. Angelis, Frederic Fiore, Jacques A. Nunès, Bernard Malissen, Laurent Greillier, G. Guittard, Hervé Luche, F. Barlesi, Daniel Olive.(2023). Abstract 5184: Anti-HVEM mAb therapy improves antitumoral immunity both in vitro and in vivo, in a novel transgenic mouse model expressing human HVEM and BTLA molecules challenged with HVEM expressing tumors.
[29] Chong-bin Hu, Chen Huang, Jie Wang, Yun Hong, Dong-dong Fan, Ye Chen, Ai-fu Lin, L. Xiang, J. Shao.(2023). Novel PD-L1/BTLA Checkpoint Axis Exploited for Bacterial Immune Escape by Restraining CD8+ T Cell-Initiated Adaptive Immunity in Zebrafish.
[30] Ryohei Kondo, Kohei Kondo, Kei Nabeshima, Akihiko Nishikimi, Y. Ishida, Toshiaki Shigeoka, Johannes M. Dijkstra.(2025). PD-1 is conserved from sharks to humans: new insights into PD-1, PD-L1, PD-L2, and SHP-2 evolution.
[31]Zhigang Rong, Fei Zhang, Zhengdong Wang, Weifeng He, S. Dong, Jianzhong Xu, F. Dai.(2018). Improved Osteogenesis by HVEM-Expressing Allogenic Bone Marrow-Derived Mesenchymal Stem Cells in an Immune Activation Condition and Mouse Femoral Defect Model.
[32] M. Marasco, Anna Berteotti, J. Weyershaeuser, N. Thorausch, Justyna Sikorska, J. Krausze, H. Brandt, Joanna Kirkpatrick, P. Ri?os, W. Schamel, M. K?hn, T. Carlomagno.(2020). Molecular mechanism of SHP2 activation by PD-1 stimulation.
[33] Ling Liu, Yan Cheng, Zhigang Zhang, Jing Li, Y. Geng, Qingsong Li, D. Luo, Li Liang, Wei Liu, Jianping Hu, W. Ouyang.(2023). Study on the allosteric activation mechanism of SHP2 via elastic network models and neural relational inference molecular dynamics simulation.
[34] C. Foster, Jasper Du, Oscar Pundel, M. Geer, Ryan C. Ripert, Jia Liu, Taylor A. Heim, K. Araki, Amanda W. Lund, Jun Wang, Ben Neel.(2025). T lymphocyte-specific deletion of SHP1 and SHP2 promotes activation-induced cell death of CD4+ T cells and impairs antitumor response.
[35] Christine Quach, Xin Li, Pedram Shafiei-Jahani, Meng Li, Stephen Shen, D. Helou, Benjamin P. Hurrell, P. Soroosh, Omid Akbari.(2025). BTLA agonist attenuates Th17-driven inflammation in a mouse model of steroid-resistant asthma.
[36] Jingjing Song, Lihui Wu.(2020). Friend or Foe: Prognostic and Immunotherapy Roles of BTLA in Colorectal Cancer.
[37] P. Diefenhardt, M. Braumann, Thomas Sch?mig, Bastian Trinsch, Claudio Sierra Gonzalez, J. Becker-Gotot, L. V?lker, Lioba Ester, Amrei M. Mandel, D. Hawiger, Ali T. Abdallah, B. Schermer, H. G?bel, P. Brinkk?tter, C. Kurts, T. Benzing, Sebastian Br?hler.(2023). Stimulation of Immune Checkpoint Molecule B and T-Lymphocyte Attenuator Alleviates Experimental Crescentic Glomerulonephritis.
[38] F. Anzengruber, D. Ignatova, T. Schlaepfer, Yun-Tsan Chang, L. French, S. Pascolo, E. Contassot, M. Bobrowicz, W. Hoetzenecker, E. Guenova.(2019). Divergent LAG-3 versus BTLA, TIGIT, and FCRL3 expression in Sézary syndrome.
[39] A. Ruggieri, M. Yarchoan, S. Goyal, Yuan Liu, E. Sharon, Helen X. Chen, Brian M Olson, C. Paulos, B. El-Rayes, S. Maithel, N. Azad, G. Lesinski.(2022). Combined MEK/PD-L1 inhibition alters peripheral cytokines and lymphocyte populations correlating with improved clinical outcomes in advanced biliary tract cancer.
[40] W. Truong, J. C. Plester, W. Hancock, S. Merani, T. Murphy, K. Murphy, J. Kaye, C. Anderson, A. M. Shapiro.(2007). Combined Coinhibitory and Costimulatory Modulation with Anti‐BTLA and CTLA4Ig Facilitates Tolerance in Murine Islet Allografts.
[41] Radhika R. Gudi, Subha Karumuthil‐Melethil, Nicolas Pérez, Gongbo Li, C. Vasu.(2019). Engineered Dendritic Cell-Directed Concurrent Activation of Multiple T cell Inhibitory Pathways Induces Robust Immune Tolerance.
[42] Tony T. Jiang, O. Kruglov, G. Lin, Angela Minic, Kimberly R. Jordan, R. Uger, M. Wong, Y. Shou, O. Akilov.(2021). Clinical Response to Anti-CD47 Immunotherapy Is Associated with Rapid Reduction of Exhausted Bystander CD4+ BTLA+ T Cells in Tumor Microenvironment of Mycosis Fungoides.
[43] A. Kosmaczewska, L. Ciszak, Anna Andrzejczak, A. Tomkiewicz, Anna Partyka, Zofia Rojek-Gajda, Irena Frydecka, Dariusz Wo?owiec, Tomasz Wróbel, A. Bojarska-Junak, Jacek Roliński, Lidia Karabon.(2025). miR-155-5p Silencing Does Not Alter BTLA Molecule Expression in CLL T Cells: Implications for Targeted Immunotherapy.
[44] D. Nishizaki, Sharon Choi, Chinmayi Pandya, Suzanna Lee, S. Pabla, P. DePietro, Taylor J. Jensen, R. Kurzrock, S. Kato.(2025). Pan-Cancer Landscape of B- and T-Lymphocyte Attenuator: Implications for Potential Immunotherapy Combinations.
[45] Binghao Li, Qinchuan Wang, Yihong Luo, Sicong Wang, Sai Pan, Wenting Zhao, Zhaoming Ye, Xifeng Wu.(2024). Peripheral Soluble Immune Checkpoint-Related Proteins Were Associated with Survival and Treatment Efficacy of Osteosarcoma Patients, a Cohort Study.
[46] Patrícia Neuperger, K. Szalontai, Nikolett Gémes, Jozsef A Balog, László Tiszlavicz, J. Furák, Gy?rgy Lázár, László G. Puskás, G. Szebeni.(2023). Single-cell mass cytometric analysis of peripheral immunity and multiplex plasma marker profiling of non-small cell lung cancer patients receiving PD-1 targeting immune checkpoint inhibitors in comparison with platinum-based chemotherapy.
[47] J. Ries, Leah Trumet, Alina Hahn, Lina Kunater, Rainer Lutz, C. Geppert, M. Kesting, Manuel Weber.(2024). The Immune Checkpoint BTLA in Oral Cancer: Expression Analysis and Its Correlation to Other Immune Modulators.
[48]Michelle E Wakeley, Brandon E Armstead, Chyna C. Gray, Elizabeth W. Tindal, Daithi S. Heffernan, C. Chung, A. Ayala.(2023). Lymphocyte HVEM/BTLA co-expression after critical illness demonstrates severity indiscriminate upregulation, impacting critical illness-induced immunosuppression.
[49]Julie Joseph, T. Premeaux, Daniel O. Pinto, Ahbishek Rao, Shrobona Guha, A. Panfil, A. Carey, L. Ndhlovu, E. Bergmann-Leitner, P. Jain.(2023). Extracellular immune checkpoint molecules released from HTLV-1-infected cells mount immune suppression in the context of neuroinflammation.
[50] Chien-Hsun Huang, Lei Cong, Jun Xie, Bo Qiao, S. Lo, T. Zheng.(2009). Rheumatoid arthritis-associated gene-gene interaction network for rheumatoid arthritis candidate genes.
[51] A. Small, S. Cole, J. J. Wang, S. Nagpal, Ling-Yang Hao, M. Wechalekar.(2022). Attenuation of the BTLA/HVEM Regulatory Network in the Circulation in Primary Sj?gren’s Syndrome.
[52] Haruka Kinosada, Jun-ichirou Yasunaga, Kazuya Shimura, P. Miyazato, Chiho Onishi, T. Iyoda, K. Inaba, M. Matsuoka.(2017). HTLV-1 bZIP Factor Enhances T-Cell Proliferation by Impeding the Suppressive Signaling of Co-inhibitory Receptors.
[53] Kai Werner, S. Dolff, Yang Dai, Xin Ma, A. Brinkhoff, J. Korth, A. G?ckler, H. Rohn, Ming Sun, J. C. Cohen Tervaert, P. van Paassen, A. Kribben, O. Witzke, B. Wilde.(2019). The Co-inhibitor BTLA Is Functional in ANCA-Associated Vasculitis and Suppresses Th17 Cells.
[54] Bin Yang, Junlong Zhang, Lixin Li, Xiaojun Lyu, Wei Wei, Zhuochun Huang, B. Cai, Lanlan Wang.(2017). Genetic variations in LIGHT are associated with susceptibility to ankylosing spondylitis in a Chinese Han population.
[55] H. Douna, J. Amersfoort, F. Schaftenaar, M. Kr?ner, Máté G Kiss, B. Slütter, M. Depuydt, Mireia N A Bernabé Kleijn, A. Wezel, H. Smeets, H. Yagita, C. Binder, I. Bot, G. V. van Puijvelde, J. Kuiper, A. Foks.(2019). BTLA stimulation protects against atherosclerosis by regulating follicular B cells.
[56] P. Diefenhardt, Marie Braumann, Bastian Trinsch, Thomas Sch?mig, Claudio Sierra Gonzalez, Bernhard Schermer, Thomas Benzing, P. Brinkkoetter, Sebastian Braehler.(2022). Immune Checkpoint Molecule BTLA Attenuates Experimental Glomerulonephritis by Directly Inhibiting T Effector Cells and Inducing Treg Differentiation.