鐵死亡
在介紹鐵死亡之前,我們先簡單了解下鐵元素在生物代謝中的作用。鐵是生命所必需的微量元素之一,在人體氧化代謝、細胞生長增殖、氧氣運輸和儲存等方面發(fā)揮著重要作用。大約一半?yún)⑴c三羧酸循環(huán)的酶和輔酶含有鐵或需要鐵作為輔因子參與ATP合成。鐵代謝失衡會引起多種病變發(fā)生。如鐵能抑制SRSF7與細胞死亡受體Fas的mRNA前體結(jié)合,導致突變的促凋亡Fas亞型表達增加。那么鐵死亡又是什么呢?鐵死亡是Stockwell在2012年發(fā)現(xiàn)的一種新型細胞死亡方式,是一種鐵依賴性的調(diào)節(jié)性細胞死亡形式,由過度的脂質(zhì)過氧化所引起。它在多種疾病的發(fā)生發(fā)展過程中發(fā)揮重要作用,比如神經(jīng)系統(tǒng)疾病、心血管疾病及各種癌癥[1]。
1、鐵死亡特點
鐵死亡(Ferroptosis )是區(qū)別于細胞凋亡、細胞壞死、細胞自噬的新型的細胞程序性死亡方式。形態(tài)上,發(fā)生鐵死亡的細胞,其細胞膜斷裂并出泡,線粒體變小、線粒體膜密度增高、線粒體脊減少或消失、線粒體外膜斷裂;細胞核大小雖然正常,但缺乏染色質(zhì)凝聚。生物學上,細胞內(nèi)鐵和ROS積累,絲裂原活化蛋白激酶(MAPK)信號傳導系統(tǒng)的激活、Cys2攝取及谷胱甘肽消耗減少、煙酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化增加。
鐵死亡主要是由于細胞內(nèi)脂質(zhì)活性氧的產(chǎn)生和降解失衡所致。 當細胞的抗氧化能力降低時,脂質(zhì)活性氧的積累會導致細胞氧化死亡,即鐵死亡。
2、細胞鐵死亡的調(diào)控機制
鐵死亡的發(fā)生發(fā)展與氨基酸、脂質(zhì)和鐵代謝的調(diào)節(jié)有關(guān),并受多種分子機制的調(diào)節(jié)。 這些機制大致可以分為三類(圖一)。
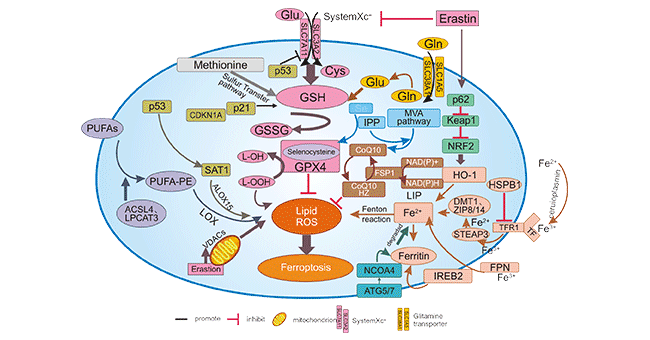
圖1. Regulatory pathways of ferroptosis
第一類是由GSH/GPX4通路調(diào)控,是主要的調(diào)控機制,如抑制胱氨酸/谷氨酸反向轉(zhuǎn)運體系統(tǒng)(SystemXc)、GPX4的調(diào)節(jié)、硫轉(zhuǎn)移系統(tǒng)、甲羥戊酸(MVA)途徑、谷氨酰胺代謝途徑和p53調(diào)節(jié)軸。SystemXc-由SLC3A2和SLC7A11二聚體組成并嵌于細胞膜表面。SLCT7A11是發(fā)揮功能的主要亞基,可將胱氨酸轉(zhuǎn)運至胞內(nèi),用于合成GSH,抑制SLCTA11表達可詳導鐵死亡發(fā)生。p53作為一種抑癌基因,就是通過下調(diào)systemXC-組分SLC7A11的表達來抑制細胞對胱氨酸的攝取,從而導致谷胱甘肽過氧化物酶活性降低,削減細胞抗氧化能力,增強細胞對鐵死亡的敏感性。
第二類是鐵穩(wěn)態(tài)調(diào)節(jié)相關(guān),如ATG5-ATGA7-NCOA4鐵自噬調(diào)節(jié)蛋白途徑、IREB調(diào)節(jié)系統(tǒng)、熱休克蛋白調(diào)節(jié)途徑、p62-Keap1-NRF2 和 HSPB1調(diào)節(jié)途徑 [2] [3]。第三類是脂類代謝的相關(guān),如PHGDH、G6PD、ACSL4和LPCAT3等;最后一個是圍繞脂質(zhì)代謝的相關(guān)通路,如P53-SAT1-ALOX15、ACSL4、LPCAT3等。 此外,Erastin 作用于線粒體可以誘導鐵死亡 [4] [5]。
3、鐵死亡相關(guān)熱門靶點
華美生物匯總了當前與鐵死亡相關(guān)的大部分熱門靶點,點擊對應(yīng)靶點可查看所有相關(guān)試劑。
● 鐵離子攝入與排出
● 鐵離子儲存
● 鐵死亡相關(guān)轉(zhuǎn)錄因子
● 氧化還原調(diào)節(jié)因子
參考文獻:
[1] Li, J., Cao, F., Yin, Hl. et al. Ferroptosis: past, present and future [J]. Cell Death Dis. 2020, 11, 88.
[2] Sun, X. et al. HSPB1 as a novel regulator of ferroptotic cancer cell death [J]. Oncogene. 2015, 34, 5617–25.
[3] Gammella, E., Recalcati, S., Rybinska, I. et al. Iron-induced damage in cardiomyopathy: oxidative-dependent and independent mechanisms [J]. Oxid. Med Cell Longev. 2015, 230182.
[4] Yang, W. S. & Stockwell, B. R. Ferroptosis: death by lipid peroxidation [J]. Trends Cell Biol. 2016, 26, 165–176.
[5] Kagan, V. E. et al. Oxidized arachidonic and adrenic PEs navigate cells to ferroptosis [J]. Nat. Chem. Biol. 2017, 13, 81–90.







